医薬品 情報
| リフレックス | |
| ミルタザピン | |
| Mirtazapine | |
| ミルタザピン |
|
| ノルアドレナリン・セロトニン |
|
| 1179 | |
| ATCコード | N06AX11 |
| KEGG DRUG |
D00563
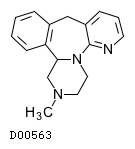
ミルタザピン
|
| JAPIC |
|
添付 文書 情報 2021年 1月 改訂 (第 5版 )
商品 情報
3.組成 ・性状
| YJコード | |||||
|---|---|---|---|---|---|
|
リフレックス |
REFLEX TABLETS | Meiji Seikaファルマ | 1179051F1029 | 85 |
|
|
リフレックス |
REFLEX TABLETS | Meiji Seikaファルマ | 1179051F2025 | 136.3 |
2. 禁忌
4. 効能 または効果
うつ病 ・うつ状態
5. 効能 または効果 に関連 する注意
6. 用法 及 び用量
7. 用法 及 び用量 に関連 する注意
8. 重要 な基本 的 注意
8.1 うつ症状 を呈 する患者 は希 死 念慮 があり、自殺 企図 のおそれがあるので、このような患者 は投与 開始 早期 並 びに投与 量 を変更 する際 には患者 の状態 及 び病態 の変化 を注意深 く観察 すること。[5.1、8.2-8.4、9.1.1、9.1.2、15.1.1参照 ]
8.2 不安 、焦燥 、興奮 、パニック発作 、不眠 、易 刺激 性 、敵意 、攻撃 性 、衝動 性 、アカシジア/精神 運動 不穏 、軽躁 、躁病 等 があらわれることが報告 されている。また、因果 関係 は明 らかではないが、これらの症状 ・行動 を来 した症例 において、基礎 疾患 の悪化 又 は自殺 念慮 、自殺 企図 、他 害 行為 が報告 されている。患者 の状態 及 び病態 の変化 を注意深 く観察 するとともに、これらの症状 の増悪 が観察 された場合 には、服薬 量 を増量 せず、徐々 に減量 し、中止 するなど適切 な処置 を行 うこと。[5.1、8.1、8.3、8.4、9.1.1-9.1.4、15.1.1参照 ]
8.3 自殺 目的 での過 量 服用 を防 ぐため、自殺 傾向 が認 められる患者 に処方 する場合 には、1回分 の処方 日数 を最小限 にとどめること。[5.1、8.1、8.2、8.4、9.1.1、9.1.2、15.1.1参照 ]
8.4 家族 等 に自殺 念慮 や自殺 企図 、興奮 、攻撃 性 、易 刺激 性 等 の行動 の変化 及 び基礎 疾患 悪化 があらわれるリスク等 について十分 説明 を行 い、医師 と緊密 に連絡 を取 り合 うよう指導 すること。[5.1、8.1-8.3、9.1.1-9.1.4、15.1.1参照 ]
8.6 投与 中止 (突然 の中止 )により、不安 、焦燥 、興奮 、浮動 性 めまい、錯覚 感 、頭痛 及 び悪心 等 があらわれることが報告 されている。投与 を中止 する場合 には、突然 の中止 を避 け、患者 の状態 を観察 しながら徐々 に減量 すること。
9. 特定 の背景 を有 する患者 に関 する注意
9.1 合併症 ・既往 歴 等 のある患者
9.1.1 自殺 念慮 又 は自殺 企図 の既往 のある患者 、自殺 念慮 のある患者
9.1.2 躁 うつ病 患者
9.1.3 脳 の器質 的 障害 又 は統合 失調 症 の素因 のある患者
9.1.4 衝動 性 が高 い併存 障害 を有 する患者
9.1.5 てんかん等 の痙攣 性 疾患 又 はこれらの既往 歴 のある患者
9.1.6 心 疾患 (心筋梗塞 、狭心症 、伝導 障害 等 )又 は低 血圧 のある患者
9.1.7 QT延長 又 はその既往 歴 のある患者 、著 明 な徐 脈 や低 カリウム血 症 等 がある患者
9.1.8 緑内障 又 は眼 内 圧 亢進 のある患者
9.1.9 排尿 困難 のある患者
9.2 腎 機能 障害 患者
9.3 肝 機能 障害 患者
9.5 妊 婦
9.6 授乳 婦
9.7 小児 等
9.7.2 海外 で実施 された7〜17歳 の大 うつ病 性 障害 (DSM-IV注 )における分類 )患者 を対象 としたプラセボ対照 の臨床 試験 において有効 性 が確認 できなかったとの報告 がある。[5.2参照 ]注 )DSM-IV:American Psychiatric Association(米国 精神 医 学会 )のDiagnostic and Statistical Manual of Mental Disorders,4th edition(DSM-IV精神 疾患 の診断 ・統計 マニュアル)
9.8 高齢 者
10. 相互 作用
CYP1A2
CYP2D6
CYP3A4
10.1 併用 禁忌
10.2 併用 注意
| CYP3A4 HIVプロテアーゼ アゾール エリスロマイシン [16.7.1 | CYP3A4の | |
| CYP3A4 カルバマゼピン フェニトイン リファンピシン [16.7.2、16.7.3 | CYP3A4の | |
| シメチジン [16.7.4 | ||
ベンゾジアゼピン ジアゼパム [16.7.5 | ||
| アルコール( [16.7.6 | ||
| セロトニン L-トリプトファン トリプタン トラマドール リネゾリド メチルチオニニウム セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート) [11.1.1、16.7.7、16.7.8 | セロトニン | セロトニン |
| ワルファリンカリウム [16.7.9 | プロトロンビン | |
| QT [9.1.7、11.1.7 | QT |
11. 副作用
11.1 重大 な副作用
11.1.1 セロトニン症候群 (頻度 不明 )
11.1.2 無 顆粒 球 症 、好 中 球 減少 症 (いずれも頻度 不明 )
11.1.3 痙攣 (頻度 不明 )
11.1.4 肝 機能 障害 、黄疸 (いずれも頻度 不明 )
11.1.5 抗 利尿 ホルモン不適合 分泌 症候群 (SIADH)(頻度 不明 )
11.1.6 皮膚 粘膜 眼 症候群 (Stevens-Johnson症候群 )、多 形 紅 斑 (いずれも頻度 不明 )
11.2 その他 の副作用
| 5% | 1〜5% | 1% | ||
| しゃっくり | ||||
| ヘモグロビン | ||||
| AST | Al-P | LDH | ||
| CK | ||||
| その |
13. 過 量 投与
13.1 症状
13.2 処置
14. 適用 上 の注意
14.1 薬剤 交付 時 の注意
PTP包装 の薬剤 はPTPシートから取 り出 して服用 するよう指導 すること。PTPシートの誤 飲 により、硬 い鋭角 部 が食道 粘膜 へ刺 入 し、更 には穿孔 をおこして縦 隔 洞 炎 等 の重 篤 な合併症 を併発 することがある。
15. その他 の注意
15.1 臨床 使用 に基 づく情報
15.1.1 海外 で実施 された大 うつ病 性 障害 等 の精神 疾患 を有 する患者 を対象 とした、本 剤 を含 む複数 の抗 うつ剤 の短期 プラセボ対照 臨床 試験 の検討 結果 において、24歳 以下 の患者 では、自殺 念慮 や自殺 企図 の発現 のリスクが抗 うつ剤 投与 群 でプラセボ群 と比較 して高 かった。なお、25歳 以上 の患者 における自殺 念慮 や自殺 企図 の発現 のリスクの上昇 は認 められず、65歳 以上 においてはそのリスクが減少 した。[5.1、8.1-8.4、9.1.1、9.1.2参照 ]
15.1.2 主 に50歳 以上 を対象 に実施 された海外 の疫学 調査 において、選択 的 セロトニン再 取 り込 み阻害 剤 及 び三 環 系 抗 うつ剤 を含 む抗 うつ剤 を投与 された患者 で、骨折 のリスクが上昇 したとの報告 がある。
15.2 非 臨床 試験 に基 づく情報
16. 薬物 動態
16.1 血 中 濃度
16.1.1 単 回 投与
| n | Tmax(hr) | Cmax(ng/mL) | T1/2(hr) | AUC0-∞(ng・hr/mL) | |
| 15 | 4 | 1.1±0.3 | 38.1±5.8 | 31.7±8.2 | 477.2±115.5 |
| 30 | 4 | 1.4±0.3 | 76.4±17.0 | 32.7±4.4 | 1006.3±116.4 |
16.1.2 反復 投与
| n | Tmax*(hr) | Cmax(ng/mL) | T1/2(hr) | AUC0-24(ng・hr/mL) | |
| 15 | 9 | 1.5 (0.75〜3) | 43.4±9.44 | − | 393±84.6 |
| 30 | 9 | 1.5 (0.75〜3) | 83.2±27.5 | − | 778±178 |
| 45 | 9 | 1.5 (0.75〜3) | 146±49.8 | 23.2±6.06 | 1147±288 |
16.2 吸収
16.2.1 食事 の影響
16.3 分布
16.3.1 血漿 蛋白 結合
16.4 代謝
16.5 排泄
16.6 特定 の背景 を有 する患者
16.6.1 腎 機能 障害 時 の血漿 中 濃度
16.6.2 肝 機能 障害 時 の血漿 中 濃度
16.6.3 高齢 者 の血漿 中 濃度
16.6.4 男女 における血漿 中 濃度
ミルタザピン20mgを1日 1回 7日間 投与 したときの定常 状態 におけるAU C0-24は、男性 に比 べ女性 で高 かった(非 高齢 者 :2.0倍 、高齢 者 :1.2倍 )。また、半減 期 は男性 に比 べて女性 で有意 に長 かった(非 高齢 者 :1.6倍 、高齢 者 :1.3倍 )12)(外国 人 データ)。
16.7 薬物 相互 作用
16.7.1 ケトコナゾール
16.7.2 カルバマゼピン
16.7.3 フェニトイン
16.7.4 シメチジン
16.7.5 ジアゼパム
16.7.6 エタノール
16.7.7 パロキセチン
16.7.8 炭酸 リチウム
16.7.9 ワルファリン
16.7.10 アミトリプチリン
16.7.11 リスペリドン
17. 臨床 成績
17.1 有効 性 及 び安全 性 に関 する試験
17.1.1 国内 第 II相 プラセボ対照 比較 試験
うつ病 患者 を対象 とした6週間 の無 作為 化 二 重 盲 検 比較 試験 を実施 した。すべての本 剤 投与 群 で初期 用量 は15mg/日 とし、30mg/日 群 及 び45mg/日 群 は2週 目 に30mgへ強制 増量 、45mg/日 群 は3週 目 に45mgへ強制 増量 し、各 群 共 に増量 後 は用量 を維持 した。本 剤 15mg/日 群 及 び30mg/日 群 の、投与 終了 (中止 )時 のHAM-D合計 スコア(17項目 )の投与 開始 前 からの変化 量 (LOCF)はプラセボ群 に比較 して有意 に大 きかった。なお、本 剤 45mg/日 群 での効果 は、30mg/日 群 を上回 るものではなかった17)。
図 HAM-D合計 スコア(17項目 )変化 量 の推移 (LOCF)
| n | HAM-D | ||
| プラセボ | 70 | −10.4(7.5) | − |
| 15mg/ | 65 | −13.3(6.8)* | −2.8(−5.3〜−0.4) |
| 30mg/ | 66 | −13.8(6.9)* | −3.4(−5.8〜−1.0) |
| 45mg/ | 69 | −11.9(7.6) | −1.6(−4.2〜0.9) |
17.1.2 国内 第 III相 フルボキサミン対照 比較 試験
うつ病 患者 を対象 とした6週間 の無 作為 化 二 重 盲 検 比較 試験 において、本 剤 投与 群 (15〜45mg/日 )の投与 終了 (中止 )時 におけるHAM-D合計 スコア(17項目 )の投与 開始 前 からの変化 量 (LOCF)は−13.8±7.3(n=95)であった。一方 、フルボキサミンマレイン酸 塩 群 (50〜150mg/日 )では−11.7±8.1(n=98)であり、変化 量 の差 とその95%信頼 区間 は−2.20(−4.35〜−0.04)であった(p=0.0462)18)。
17.1.3 国内 第 II相 長期 投与 試験
うつ病 患者 を対象 とした52週間 投与 (15〜45mg/日 )により、HAM-D合計 スコア(17項目 )は、投与 開始 前 の10.2±6.5(n=107)から投与 開始 6週 では、6.9±5.1となった(OC)。投与 6週 後 以降 、投与 52週 後 (4.0±5.2)まで7未満 で安定 して推移 し、本 剤 の長期 投与 での効果 が確認 された。また、本 剤 30mg/日 から45mg/日 への増量 により改善 した症例 も認 められた19)。
| n | 107 | 100 | 97 | 83 | 71 |
| HAM-D | 10.2 (6.5) | 6.9 (5.1) | 5.7 (4.9) | 4.1 (4.1) | 4.0 (5.2) |
18. 薬効 薬理
18.1 作用 機 序
18.2 抗 うつ作用
19. 有効 成分 に関 する理化学 的 知見
19.1. ミルタザピン
22. 包装
<リフレックス錠 15mg>
PTP包装
100錠 (10錠 ×10) 500錠 (10錠 ×50) 1000錠 (10錠 ×100)
バラ包装 (ボトル入 )
500錠
<リフレックス錠 30mg>
PTP包装
100錠 (10錠 ×10)
23. 主要 文献
- Kristensen,J.H.,et al., Br.J.Clin.Pharmacol., 63 (3), 322-327, (2007) »PubMed »DOI
- Ruigt,G.S.F.,et al., Eur.J.Clin.Pharmacol., 38 (6), 551-554, (1990) »PubMed »DOI
-
社内 資料 :薬理 試験 (2009年 7月 7日 承認 、CTD2.6.2.2) -
大谷 義夫 ほか,基礎 と臨床 , 24 (10), 5365-5377, (1990) -
社内 資料 :反復 投与 試験 (2009年 7月 7日 承認 、CTD2.7.2.2) -
社内 資料 :食事 の影響 試験 (2009年 7月 7日 承認 、CTD2.7.1.2) -
社内 資料 :血漿 タンパクとの結合 (2009年 7月 7日 承認 、CTD2.7.2.2) - Dahl,M.-L.,et al., Clin.Drug Invest., 13 (1), 37-46, (1997)
-
社内 資料 :マスバランス試験 (2009年 7月 7日 承認 、CTD2.7.2.2) - Bengtsson,F.,et al., Hum.Psychopharmacol.Clin.Exp., 13, 357-365, (1998)
-
社内 資料 :肝 機能 低下 の影響 (2009年 7月 7日 承認 、CTD2.7.2.2) - Timmer,C.J.,et al., Human psychopharmacology., 11, 497-509, (1996)
-
社内 資料 :薬物 相互 作用 (2009年 7月 7日 承認 、CTD2.7.2.2) - Spaans,E.,et al., Eur.J.Clin.Pharmacol., 58, 423-429, (2002) »PubMed »DOI
- Sitsen,J.M.A.,et al., J.Psychopharmacol., 14 (2), 172-176, (2000) »PubMed »DOI
- Loonen,A.J.M.,et al., Eur.Neuropsychopharmacol., 10, 51-57, (1999) »PubMed »DOI
-
木下 利彦 ,臨床 精神 薬理 , 12 (2), 289-306, (2009) -
村崎 光邦 ほか,臨床 精神 薬理 , 13 (2), 339-355, (2010) -
木下 利彦 ,臨床 精神 薬理 , 12 (3), 503-520, (2009) - Haddjeri,N.,et al., J.Pharmacol.Exp.Ther., 277 (2), 861-871, (1996) »PubMed
- Andrews,J.S.,et al., Drug Dev.Res., 32 (2), 58-66, (1994)
- O'Connor,W.T.,et al., Neuropharmacology., 25 (3), 267-270, (1986) »PubMed »DOI
- Nowakowska,E.,et al., Pol.J.Pharmacol., 51 (6), 463-469, (1999) »PubMed
24. 文献 請求 先 及 び問 い合 わせ先
Meiji Seikaファルマ株式会社
くすり相談 室
〒104-8002
東京 都 中央 区 京橋 2-4-16
03-3273-3539
FAX:03-3272-2438
Meiji Seikaファルマ株式会社
くすり相談 室
〒104-8002
東京 都 中央 区 京橋 2-4-16
03-3273-3539
FAX:03-3272-2438
26. 製造 販売 業者 等
26.1 製造 販売元
Meiji Seikaファルマ株式会社