Fosforpentoksied
| Fosforpentoksied | |
|---|---|
| |
| Chemie | |
| Chemiese formule | P4O10 |
| CAS-nommer | 1314-56-3 |
| Molêre massa | 283,9 g/mol |
| Voorkoms | wit poeier |
| Reuk | reukloos |
| Digtheid | 2,39 g/cm3 |
| Smeltpunt | 340 °C |
| Kookpunt | 360 °C (sublimeer) |
| Oplosbaarheid | eksotermiese hidrolise |
| Kristalstruktuur | ortorombies a:919,3(9) pm b:489,0(4) pm c:716,2(7)pm |
| Ruimtegroep | Pnma nommer: 62 |
Fosforpentoksied is 'n chemiese verbinding met molekulêre formule P4O10 (met sy algemene naam afgelei van sy empiriese formule, P2O5). Hierdie wit kristallyne vaste stof is die anhidried van fosforsuur. Dit is 'n kragtige droogmiddel en dehidreermiddel.
Struktuur
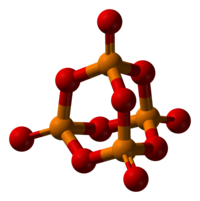
[wysig | wysig bron]Fosforpentoksied kristalliseer in ten minste vier vorme of polimorfe. Die bekendste een, 'n metastabiele vorm, bestaan uit molekules van P4O10). Swak van der Waals kragte hou hierdie molekules bymekaar in 'n seskantige rooster (Ten spyte van die hoë simmetrie van die molekules is die kristalpakking egter nie 'n digte pakking nie).[1] Die struktuur van die P4O10-hok herinner aan adamantaan met T d simmetriepuntgroep. Dit is nou verwant aan die ooreenstemmende anhidried van fosforsuur, P4O6. Laasgenoemde het nie terminale oksogroepe nie. Die digtheid daarvan is 2,30 g/cm3. Dit kook op 423 °C onder atmosferiese druk; as dit vinniger verhit word, kan dit sublimeer. Hierdie vorm kan gemaak word deur die damp van fosforpentoksied vinnig te kondenseer, en die resultaat is 'n uiters higroskopiese vastestof.[2]
Die ortorombiese vorm wat by 233K die stabielste is en wat met o′-(P2O5)∞ aangedui word, is 'n tweedimensionale polimeer. Dit bevat lae van geplooide sesledige ringe van PO4-tetraëders wat hoeke met mekaar deel.[3]
 |
 |
| deel van 'n o′-(P2O5)∞ laag | o′-(P2O5)∞ laagstapeling |
Bereiding
[wysig | wysig bron]P4O10 word berei deur wit fosfor te verbrand met 'n voldoende toevoer van suurstof:[4]
- P4 + 5 O2 → P4O10
Die dehidrasie van fosforsuur om fosforpentoksied te gee is nie moontlik nie, aangesien dit by verhitting verskeie polifosfate vorm, maar nie genoegsaam sal dehidreer om P4O10 te vorm nie.
Verwysings
[wysig | wysig bron]- ↑ Cruickshank, D. W. J. (1964). "Refinements of Structures Containing Bonds between Si, P, S or Cl and O or N: V. P4O10". Acta Crystallogr. 17 (6): 677–9. doi:10.1107/S0365110X64001669.
- ↑ .Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. p. 473. ISBN 978-0-13-175553-6.
- ↑ Stachel, D., Svoboda, I. and Fuess, H. (1995). "Phosphorus Pentoxide at 233 K.". Acta Cryst. C. 51: 1049–1050. doi:10.1107/S0108270194012126.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ Threlfall, Richard E., (1951). The story of 100 years of Phosphorus Making: 1851 - 1951. Oldbury: Albright & Wilson Ltd
