Radiu atómicu
El radiu atómicu ye la distancia ente'l nucleu del átomu y l'electrón estable más alloñáu del mesmu. Suel midise en picómetros (1 pm=10-12 m) o Ángstrom (1 Å=10-10 m).
| Radiu atómicu | |
|---|---|
|
chemical formalism (en) | |
|
propiedá física, Radiu y aproximación (es) | |
 | |
Al ser los nucleos y los electrones partícules cuántiques, sometíes al principiu d'indeterminación de Heisenberg, les midíes direutes de distancies nun puen tener más qu'un significáu estadísticu. Convencionalmente defínese como la metá de la distancia ente los centros de dos átomos enllaciaos, y dependiendo d'esi enllaz podemos falar de radios atómicos, iónicos, metálicos o de van der Waals.
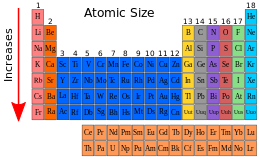
Acordies col tipu d'enllaz químicu defínense tamién otros radios como'l covalente (xeneralmente pa elementos non metálicos) y l'iónicu (pa elementos metálicos). Allugaos agora na tabla periódica, una cenciella regla nemotécnica pa recordar el mou nel qu'aumenta'l radiu atómicu ye la siguiente:
- El radiu atómicu d'un elementu aumenta d'arriba abaxo y de drecha esquierda na tabla periódica.
La esplicación a esti fenómenu alcuéntrase en que la fuercia d'atraición que'l nucleu del átomu exerz nos electrones ye mayor al final de cada periodu, de manera que los electrones de los átomos de los elementos asitiaos más a la drecha tán más atrayíos pol nucleu, de mou que como'l númberu de niveles nel que s'enllacien los átomos ye'l mesmu, el radiu amenorga.
Al empar qu'esto, en cada periodu aumenta nuna unidá'l númberu de capes nel que se distribúin los electrones del átomu, de manera que los átomos de los elementos de mayor periodu tienen mayor radiu.