Fosfat
 | |
| Substància química | classe estructural d'entitats químiques |
|---|---|

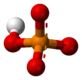
Un fosfat, en química inorgànica, és una sal d'àcid fosfòric. En química orgànica, un fosfat (o organofosfat), és un èster d'àcid fosfòric. Tenen en comú un àtom de fòsfor rodejat per quatre àtoms d'oxigen en forma tetraèdrica.
Els fosfats juguen un important paper en la bioquímica i en la biogeoquímica. Els secundaris i els terciaris són insolubles en aigua, llevat dels fosfats de sodi, potassi i amoni.
Els fosfats inorgànics s'extreuen de mines per tal d'obtenir fòsfor que es fa servir en l'agricultura i la indústria.[1] A temperatures elevades en l'estat sòlid, els fosfats poden experimentar una reacció de condensació i formar pirofosfats.
Propietats químiques
[modifica]
L'ió fosfat és un ió poliatòmic amb la fórmula empírica PO₄3− i una massa molar de 94,97 g/mol. Conté un àtom central de fòsfor envoltat per quatre àtoms d'oxigen dins una disposició en tetràedre. Es forma una sal de fosfat quan un ió carregat positivament s'uneix a àtoms d'oxigen de l'ió carregats negativament formant un compost químic iònic. Molts fosfats no són solubles en l'aigua a temperatures i pressions estàndard. Els fosfats de sodi, potassi, rubidi, cesi i amoni són tots ells solubles en l'aigua. Els pirofosfats són majoritàriament solubles en aigua.
El fosfat aquos existeix en quatre formes: En condicions fortament bàsiques, l'ió fosfat (PO₄3−) predomina, mentre que en condicions lleugerament bàsiques el prevalent és l'ió hidrogenfosfat (HPO₄2−). En condicions feblement àcides, l'ió dihidrogenfosfat (H₂PO₄−) és el més comú. La principal forma en condicions fortament àcides ho és l'àcid fosfòric (H
3PO
4).
-
H
3PO
4Àcid fosfòric -
H
2PO−
4Dihidrogenfosfat -
HPO2−
4Hidrogenfosfat -
PO3−
4Fosfat
Més exactament, considerant les tres reaccions d'equilibri següents:
les corresponents constants a 25 °C (en mol/L) són (vegeu àcid fosfòric):
- (pKa1 2.12)
- (pKa2 7.21)
- (pKa3 12.67)
Per a un pH neutre com en el citosol, pH=7,0
El fosfat pot formar molts ions polimèrics com el difosfat (també conegut com a pirofosfat), P
2O4−
7, i trifosfat, P
3O5−
10. Els diversos ions metafosfat (els quals normalment són polímers linears llargs) tenen la fórmula empírica de PO−
3 i es troben en molts compostos.
Bioquímica dels fosfats
[modifica]En els sistemes biològics, el fòsfor es troba com fosfats lliures en la solució i s'anomena fosfat inorgànic, per diferenciar-lo dels fosfats dels èsters d'àcid fosfòric. La notació del fosfat inorgànic en general és com Pi i consta, en pH neutre, d'una mescla d'ions de HPO2−
4 i H
2PO−
4.
Es pot crear fosfat inorgànic per hidròlisi de pirofosfat, la qual s'expressa com PPi:
Tanmateix, els fosfats, de forma més comuna, es troben en la forma de fosfats d'adenosina, (AMP, ADP i ATP) i en ADN i ARN i es poden alliberar per hidròlisi d'ATP o ADP. Reaccions similars existeixen en els altres nucleòsids. Els enllaços fosfoanhídrids en l' ADP i ATP, o altres nucleòsids de difosfats o trifosfats, contenen grans quantitats d'energia amb un paper vital en tots els organismes vius.
Afegir o treure fosfat de les proteïnes en totes les cèl·lules és una estratègia clau en la regulació dels processos del metabolisme.
El fosfat és també útil en les cèl·lules com agent amortidor.
Els fosfats és el material estructural dels ossos i les dents (em forma d'hidroxiapatita)
Les plantes capturen el fòsfor a través de diversos procediments: per fongs micorriza i de manera directa.
Presentació i mineria
[modifica]
Els fosfats són la manera natural com es troba el fòsfor en molts minerals fosfatats.
A Amèrica del Nord els dipòsits més grans de roques fosfatades (fosforita) es troben a la regió Bone Valley de Florida, els Soda Springs d'Idaho, i la costa de carolina del Nord. L'illa amb més fosfats del món és Nauru. També hi ha importants dipòsits de fosforites a Egipte, Israel, Marroc, Illa Navassa, Tunísia, Togo i Jordània.
Ecologia
[modifica]
En termes ecològics el fòsfor és activament cercat pels organismes vius i una vegada usat és un nutrient limitant en el medi ambient i la seva disponibilitat regula la taxa de creixement dels organismes. Això és particularment cert en els ambients d'aigua dolça, en canvi en els ambients marins el nutrient limitant és sovint el nitrogen. L'abocament de grans quantitats de fòsfor porta a l'eutrofització de l'aigua, però no tot el fòsfor es troba en la forma molecular que les algues poden degradar i consumir.[3]
Els dipòsits de fosfat poden contenir quantitats significatives de metalls pesants. En la mineria dels fosfats apareixen acumulats alts nivells de cadmi, plom, niquel, coure, crom i urani tòxics.[4]
A Alemanya, l'ús de fertilitzants fosfatats contaminats amb urani ha elevat significativament els nivells d'urani en l'aigua potable.[5]
Referències
[modifica]- ↑ «Phosphate Primer». Arxivat de l'original el 2008-06-20. [Consulta: 6 juliol 2014].
- ↑ Campbell, Neil A.; Reece, Jane B.. Biology. Seventh. San Francisco, California: Benjamin Cummings, 2005, p. 65. ISBN 0-8053-7171-0.
- ↑ Hochanadel, Dave. «Limited amount of total phosphorus actually feeds algae, study finds». Lake Scientist, 10-12-2010. [Consulta: 10 juny 2012]. «[B]ioavailable phosphorus – phosphorus that can be utilized by plants and bacteria – is only a fraction of the total, according to Michael Brett, a UW engineering professor ...»
- ↑ Gnandil, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. «The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo». Mine Water and the Environment, 25, 1, 3-2006, pàg. 56–62. DOI: 10.1007/s10230-006-0108-4.
- ↑ «Hintergründe: Uran im Dünger». www.umweltinstitut.org. Arxivat de l'original el 2013-02-05. [Consulta: 10 gener 2013].




![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}{[{\mbox{H}}_{3}{\mbox{PO}}_{4}]}}\simeq 7.5\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e81fc5d22c187e5acc19c15b8422a604474b916)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{HPO}}_{4}^{2-}]}{[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}}\simeq 6.2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c10e3502ce38d504ebf659f7411f2d2f24015c25)
![{\displaystyle K_{a3}={\frac {[{\mbox{H}}^{+}][{\mbox{PO}}_{4}^{3-}]}{[{\mbox{HPO}}_{4}^{2-}]}}\simeq 2.14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/42097ca31fd0468791802af675f407bda4e4c871)
![{\displaystyle {\frac {[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}{[{\mbox{H}}_{3}{\mbox{PO}}_{4}]}}\simeq 7.5\times 10^{4}{\mbox{, }}{\frac {[{\mbox{HPO}}_{4}^{2-}]}{[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}}\simeq 0.62{\mbox{, }}{\frac {[{\mbox{PO}}_{4}^{3-}]}{[{\mbox{HPO}}_{4}^{2-}]}}\simeq 2.14\times 10^{-6}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0427e0d0ee1ab0bb038e0709990910621b63bc72)
