Oxid vápenatý: Porovnání verzí
m rozšíření |
→Použití: popis videa, hašení vápna značka: editace z Vizuálního editoru |
||
| (Není zobrazeno 88 mezilehlých verzí od 53 dalších uživatelů.) | |||
| Řádek 1: | Řádek 1: | ||
{{Různé významy|redirect=Pálené vápno|tento=páleném vápně (oxidu vápenatém)|stránka=vápno}} |
|||
{{Infobox Chemická sloučenina |
|||
{{Infobox - chemická sloučenina |
|||
|Název=Oxid vápenatý |
|||
| název = Oxid vápenatý |
|||
|Obrázek=[[Soubor:Calcium-oxide-3D-vdW.png|150px]] |
|||
| obrázek = Calcium-oxide-3D-vdW.png |
|||
|Systematický název=Oxid vápenatý |
|||
| velikost obrázku = 150px |
|||
|Triviální název= pálené vápno |
|||
| obrázek2 = Oxid vápenatý.PNG |
|||
|Anglický název=Calcium oxide |
|||
| velikost obrázku2 = 250px |
|||
|Německý název=Calciumoxid |
|||
| systematický název = Oxid vápenatý |
|||
|Sumární vzorec=CaO |
|||
| triviální název = pálené vápno |
|||
|Vzhled=bílá pevná práškovitá látka |
|||
| anglický název = Calcium oxide |
|||
|Číslo CAS=1305-78-8 |
|||
| německý název = Calciumoxid |
|||
|Molární hmotnost= 56,1 g/mol |
|||
| sumární vzorec = CaO |
|||
|Teplota tání=2572 °C |
|||
| vzhled = bílá pevná práškovitá látka |
|||
|Teplota varu=2850 °C |
|||
| číslo CAS = 1305-78-8 |
|||
| PubChem = 14778 |
|||
|Hustota=3,350 g/cm³ (''teplota/skupenství'') |
|||
| UN kód = 1910 |
|||
|Rozpustnost=reaguje s vodou |
|||
| SMILES = [Ca]=O |
|||
|Standardní slučovací entalpie = 635,09 kJ/mol (pevný) |
|||
| číslo RTECS = EW3100000 |
|||
|Standardní molární entropie = 39,79 J·mol<sup>-1</sup>·K<sup>-1</sup> |
|||
| molární hmotnost = 56,08 g/mol |
|||
| teplota tání = 2 580 °C |
|||
|R-věty={{R34}}, {{R36}}, {{R41}} |
|||
| teplota varu = 2 850 °C |
|||
|S-věty={{S2}}, {{S8}}, {{S22}}, {{S24/25}}, {{S26}}, {{S27}}, {{S28}}, {{S36/37/39}} |
|||
| hustota = 3,316 g/cm³ |
|||
| index lomu = ''n''<sub>D</sub>=1,837 |
|||
| rozpustnost = 0,131 hm.% (''0 °C'')<br />0,123 hm.% (''20 °C'')<br />0,096 hm.% (''50 °C'')<br />0,05 hm.% (''100 °C'') |
|||
| měrná magnetická susceptibilita = −3,4×10<sup>−6</sup> cm<sup>3</sup> g<sup>−1</sup> |
|||
| krystalová struktura = [[Krystalografická soustava#Krychlová (kubická)|krychlová]] plošně centrovaná |
|||
| hrana mřížky = a= 481,08 [[pikometr|pm]] |
|||
| standardní slučovací entalpie = −635,07 kJ/mol |
|||
| entalpie tání = 1 343 J/g |
|||
| standardní molární entropie = 38,1 JK<sup>−1</sup>mol<sup>−1</sup> |
|||
| standardní slučovací Gibbsova energie = −604,04 kJ/mol |
|||
| izobarické měrné teplo = 0,763 JK<sup>−1</sup>g<sup>−1</sup> |
|||
| R-věty = {{R|34}}, {{R|36}}, {{R|41}} |
|||
| S-věty = {{S|2}}, {{S|8}}, {{S|22}}, {{S|24/25}}, {{S|26}}, {{S|27}}, {{S|28}}, {{S|36/37/39}} |
|||
| NFPA 704 = {{NFPA 704 |
|||
| zdraví = 3 |
|||
| hořlavost = 0 |
|||
| reaktivita = 2 |
|||
| ostatní rizika = |
|||
}} |
|||
| symboly nebezpečí GHS = {{GHS05}}{{GHS07}}<ref name=pubchem_cid_14778>{{Citace elektronického periodika | titul = Calcium oxide | periodikum = pubchem.ncbi.nlm.nih.gov | vydavatel = PubChem | url = https://pubchem.ncbi.nlm.nih.gov/compound/14778 | jazyk = en | datum přístupu = 2021-05-23 }}</ref><br>{{Nebezpečí}}<ref name=pubchem_cid_14778 /> |
|||
}} |
}} |
||
'''Oxid vápenatý''' ( |
'''Oxid vápenatý''' ([[chemický vzorec]] [[vápník|Ca]][[kyslík|O]]), triviálními názvy '''pálené vápno''' nebo též '''nehašené vápno''' je široce rozšířená běžně používaná [[chemická sloučenina]]. Oxid vápenatý je bílá [[žíravina|žíravá]] a [[Zásady (chemie)|alkalická]] krystalická látka. Komerčně vyráběný oxid vápenatý také často obsahuje příměsi [[oxid hořečnatý|oxidu hořečnatého]], [[oxid křemičitý|oxidu křemičitého]] a malá množství [[oxid hlinitý|oxidu hlinitého]] a [[oxid železitý|oxidu železitého]].<ref>{{Citace elektronického periodika |
||
| titul = Oxid vápenatý - E 529 |
|||
| periodikum = Doktorka.cz |
|||
| url = https://ecka-databaze.doktorka.cz/protispekave-latky-regulatory-kyselosti-plnidla/oxid-vapenaty-e-529 |
|||
| jazyk = cs |
|||
| datum přístupu = 2020-11-02 |
|||
| url archivu = https://web.archive.org/web/20201109015339/https://ecka-databaze.doktorka.cz/protispekave-latky-regulatory-kyselosti-plnidla/oxid-vapenaty-e-529 |
|||
| datum archivace = 2020-11-09 |
|||
}}</ref> |
|||
Oxid vápenatý je obvykle vyráběn tepelným rozkladem hornin, jako je [[vápenec]], který obsahuje [[uhličitan vápenatý]] (CaCO<sub>3</sub> ve formě minerálů [[kalcit]]u a [[aragonit]]u). Rozklad je prováděn zahříváním jemně mleté horniny na teplotu přesahující 825 [[stupeň Celsia|°C]].<ref name="merck">Merck Index of chemicals and Drugs, 9th ed. monograph 1650</ref> Tento proces je nazýván [[kalcinace]] nebo též ''pálení vápna''. Uvolňuje se při něm [[oxid uhličitý]] (CO<sub>2</sub>) a uhličitan se přeměňuje na oxid vápenatý (CaO). Jako palivo se používá nejčastěji [[hnědé uhlí]], [[koks]], [[černé uhlí]] (respektive [[antracit]]) nebo [[zemní plyn]]. Dříve se jako palivo používalo též [[dřevo]]. |
|||
{{vzorec|CaCO<sub>3</sub> → CaO + CO<sub>2</sub>}} |
|||
Tento proces je reverzibilní a proto od okamžiku, kdy je vypálené vápno ochlazeno, začíná vstřebávat okolní [[oxid uhličitý]] ze vzduchu a po čase se opět změní na původní uhličitan. Pálení vápna patří mezi první chemické procesy objevené člověkem již v |
Tento proces je reverzibilní, a proto od okamžiku, kdy je vypálené vápno ochlazeno, začíná vstřebávat okolní [[oxid uhličitý]] ze vzduchu a po čase se opět změní na původní uhličitan. Pálení vápna patří mezi první chemické procesy objevené člověkem již v [[pravěk]]u. |
||
== Použití == |
== Použití == |
||
[[Soubor:09. Гасење вар како силно егзотермен процес.webm|náhled|vlevo|280px|Vývoj tepla při hašení vápna]] |
|||
Jako hydratované nebo též triviálně [[hašené vápno]] ve formě [[hydroxid vápenatý|hydroxidu vápenatého]] Ca(OH)<sub>2</sub> (název tohoto minerálu je [[portlandit]]). Je využíván jako součást [[Malta (stavebnictví)|malty]] a [[sádra|sádry]] ke zvýšení tvrdosti materiálu. Příprava hašeného vápna je velmi jednoduchá, neboť oxid vápenatý je jeho zásaditý [[anhydrid]] a s [[voda|vodou]] reaguje velmi živě. |
|||
Jako hydratované nebo též triviálně hašené vápno ve formě [[hydroxid vápenatý|hydroxidu vápenatého]] Ca(OH)<sub>2</sub> (název tohoto minerálu je [[portlandit]]). Je využíván jako součást [[malta (materiál)|malty]] a [[hemihydrát síranu vápenatého|sádry]] ke zvýšení tvrdosti materiálu. Příprava hašeného vápna je velmi jednoduchá, neboť oxid vápenatý je jeho zásaditý [[anhydrid]] a s [[voda|vodou]] reaguje velmi rychle a [[Exotermická reakce|exotermně]]. |
|||
Historicky nejstarší využití vápna bylo ve stavebnictví – v [[omítka|omítkách]] je používali již |
|||
[[starověký Řím|starověcí Římané]]. Při nedostatku vápence kvůli tomu dokonce někdy byly rozbíjeny [[mramor]]ové sochy |
|||
CaO + H<sub>2</sub>O → Ca(OH)<sub>2</sub> |
|||
Oxid vápenatý je též používán při výrobě [[sklo|skla]] a díky své schopnosti reagovat s [[křemičitany]] je používán v moderních postupech výroby [[ocel]]í a [[hořčík]]ových, [[hliník]]ových a jiných neželezných kovů. Napomáhá vyplavování nečistot do [[struska|strusky]]. |
|||
Historicky nejstarší využití vápna bylo ve stavebnictví – v [[omítka|omítkách]] je používali již [[starověký Řím|starověcí Římané]]. Při nedostatku vápence kvůli tomu dokonce někdy byly rozbíjeny [[mramor]]ové sochy. |
|||
Bývá také používán jako přísada pro úpravu vody. Snižuje její [[kyselost]], změkčuje ji, funguje jako [[flokulace|flokulant]] (sbaluje koloidní nečistoty) a napomáhá odstraňování [[fosforečnany|fosfátů]] a jiných nečistot. |
|||
Oxid vápenatý je též používán při výrobě [[sklo|skla]] a díky své schopnosti reagovat s [[křemičitany]] je používán v moderních postupech výroby [[ocel]]í a [[hořčík]]ových, [[hliník]]ových a jiných neželezných [[kovy|kovů]]. Napomáhá vyplavování nečistot do [[struska|strusky]]. |
|||
V [[papír]]nictví pomáhá rozpouštět [[lignin]], působí jako [[koagulant]] a [[bělidlo]]. |
|||
Bývá také používán jako přísada pro úpravu vody. Snižuje její [[pH|kyselost]], změkčuje ji, funguje jako [[flokulace|flokulant]] (sbaluje koloidní nečistoty) a napomáhá odstraňování [[fosforečnany|fosfátů]] a jiných nečistot. |
|||
V [[zemědělství]] a [[lesnictví]] snižuje kyselost půdy. Bývá též používán jako účinná složka při čistění a odsiřování plynných spodin. |
|||
V [[papír]]nictví pomáhá rozpouštět [[lignin]], působí jako [[koagulant]] a [[bělidlo]]. |
|||
Tradičně bývá používán při pohřbívání mrtvých těl do otevřených hrobů zvláště v období epidemíí například [[mor]]u za účelem dezinfekce a zamezení zápachu rozkladu. |
|||
Ve [[forenzní analýza|forenzních vědách]] je používán k detekci [[otisky prstů|otisků prstů]]. Jako dehydratační činidlo se používá k čištění [[kyselina citronová|kyseliny citronové]], [[Glukóza|glukosy]], [[barviva|barviv]] a jako pohlcovač CO<sub>2</font>. Často bývá používán v [[hrnčířství]], [[malířství]] a potravinářství. |
|||
V [[zemědělství]] a [[lesnictví]] snižuje kyselost půdy. Bývá též používán jako účinná složka při čistění a [[odsíření|odsiřování]] [[zplodiny hoření|plynných zplodin]]. |
|||
Energie uvolňená reakcí oxidu vápenatého s vodou bývá používaná jako zdroj tepla k ohřevu speciálních samoohřevných konzerv jídla. |
|||
Tradičně bývá používán při pohřbívání mrtvých těl do otevřených hrobů zvláště v období epidemií například [[mor]]u za účelem dezinfekce a zamezení zápachu rozkladu. |
|||
Roční světová produkce oxidu vápenatého je asi 130 milionů tun. Největší producenti USA a Čína vyprodukují sami o sobě každý přibližně 20 milionů tun.[http://indexmundi.com/en/commodities/minerals/lime/lime_t9.html] |
|||
Ve [[forenzní vědy|forenzních vědách]] je používán k detekci [[papilární linie|otisků prstů]]. Jako dehydratační činidlo se používá k čištění [[kyselina citronová|kyseliny citronové]], [[glukóza|glukosy]], [[pigment|barviv]] a jako pohlcovač CO<sub>2</sub>. Často bývá používán v [[hrnčířství]], [[malířství]] a potravinářství. |
|||
== Související články == |
|||
{{Portál Chemie}} |
|||
Energie uvolněná reakcí oxidu vápenatého s vodou bývá používaná jako zdroj tepla k ohřevu speciálních samoohřevných konzerv jídla. |
|||
* [[Hydroxid vápenatý]] |
|||
* [[Uhličitan vápenatý]] |
|||
Roční světová produkce oxidu vápenatého je asi 130 milionů tun. Největší producenti, USA a Čína, vyprodukují každý přibližně 20 milionů tun.<ref>http://indexmundi.com/en/commodities/minerals/lime/lime_t9.html</ref> |
|||
=== Využití ve stavebnictví === |
|||
Dle jakosti surovin lze vyrobit dva druhy vápna, které se ve stavebnictví technicky označuje jako tzv. vzdušné vápno.<ref name="Dědek">Stavební materiály pro 1. roční SPŠ stavebních. M. Dědek, F. Vošický</ref> |
|||
==== Druhy vzdušného vápna bílého ==== |
|||
{| class="wikitable" |
|||
|- |
|||
! Označení !! Značení !! Obsah CaO + MgO <sup>''1''</sup> !! Obsah MgO <sup>''1, 2''</sup> !! Obsah SO<sub>3</sub> <sup>''1''</sup> |
|||
|- |
|||
| Bílé vápno 90 || CL90 || ≥90 || ≤5 || ≤2 |
|||
|- |
|||
| Bílé vápno 80 || CL80 || ≥80 || ≤5 || ≤2 |
|||
|- |
|||
| Bílé vápno 70 || CL70 || ≥70 || ≤5 || ≤2 |
|||
|} |
|||
{| class="wikitable" |
|||
|- |
|||
! Doplňující třídění !! Přípona |
|||
|- |
|||
| Nehašené vápno || Q |
|||
|- |
|||
| Hašené vápno bílé || S |
|||
|- |
|||
|} |
|||
:Pozn.: |
|||
* <sup>''1''</sup> Hodnoty uvedené v hmotnostních %. Pro nehašené vápno platí přímo. U nehašeného vápna se vápenné kaše po odpočtu volné a vázané vody |
|||
* <sup>''2''</sup> Vyhoví-li zkoušce objemové stálosti dle ČSN EN 459 – 2, připouští se až 7%. |
|||
==== Druhy vzdušného vápna dolomitického ==== |
|||
{| class="wikitable" |
|||
|- |
|||
! Označení !! Značení !! Obsah CaO + MgO <sup>''1''</sup> !! Obsah MgO <sup>''1, 2''</sup> !! Obsah SO<sub>3</sub> <sup>''1''</sup> |
|||
|- |
|||
| Dolomitické vápno 85 || DL85 || ≥85 || ≤30 || ≤2 |
|||
|- |
|||
| Dolomitické vápno 80 || DL80 || ≥80 || ≥5 || ≤2 |
|||
|- |
|||
|} |
|||
{| class="wikitable" |
|||
|- |
|||
! Doplňující třídění !! Přípona |
|||
|- |
|||
| Polohašené vápno dolomitické || S1 |
|||
|- |
|||
| Plně hašené vápno dolomitické || S2 |
|||
|- |
|||
|} |
|||
:Pozn.: |
|||
* <sup>''1''</sup> Hodnoty uvedené v hmotnostních %. Pro nehašené vápno platí přímo. U nehašeného vápna se vápenné kaše po odpočtu volné a vázané vody |
|||
* <sup>''2''</sup> Vyhoví-li zkoušce objemové stálosti dle ČSN EN 459 – 2, připouští se až 7%. |
|||
== Reference == |
== Reference == |
||
<references/> |
<references /> |
||
== Literatura == |
|||
* {{Citace monografie |
|||
| příjmení = VOHLÍDAL |
|||
| jméno = JIŘÍ |
|||
| příjmení2 = ŠTULÍK |
|||
| jméno2 = KAREL |
|||
| příjmení3 = JULÁK |
|||
| jméno3 = ALOIS |
|||
| rok = 1999 |
|||
| titul = Chemické a analytické tabulky |
|||
| vydavatel = Grada Publishing |
|||
| místo = Praha |
|||
| isbn = 80-7169-855-5 |
|||
| vydání = 1 |
|||
}} |
|||
== Externí odkazy == |
|||
* {{Commonscat}} |
|||
{{Oxidy II.}} |
{{Oxidy II.}} |
||
{{Anorganické soli vápenaté}} |
|||
{{Autoritní data}} |
|||
{{Portály|Architektura a stavebnictví|Chemie}} |
|||
[[Kategorie:Oxidy|Vápenatý]] |
[[Kategorie:Oxidy|Vápenatý]] |
||
[[Kategorie:Vápenaté sloučeniny]] |
[[Kategorie:Vápenaté sloučeniny]] |
||
[[Kategorie:Stavební materiály]] |
[[Kategorie:Stavební materiály]] |
||
[[Kategorie:Dehydratační činidla]] |
|||
[[ |
[[Kategorie:Desikanty]] |
||
[[ar:أكسيد الكالسيوم]] |
|||
[[ay:Q'atawi]] |
|||
[[bg:Негасена вар]] |
|||
[[ca:Calç]] |
|||
[[da:Kalciumoxid]] |
|||
[[de:Calciumoxid]] |
|||
[[en:Calcium oxide]] |
|||
[[eo:Kalko]] |
|||
[[es:Óxido de calcio]] |
|||
[[et:Kaltsiumoksiid]] |
|||
[[eu:Kare]] |
|||
[[fa:کلسیم اکسید]] |
|||
[[fi:Kalkki]] |
|||
[[fr:Oxyde de calcium]] |
|||
[[gl:Cal]] |
|||
[[he:סיד]] |
|||
[[hu:Kalcium-oxid]] |
|||
[[it:Ossido di calcio]] |
|||
[[ja: |
|||
[[ko:생석회]] |
|||
[[lt:Kalcio oksidas]] |
|||
[[lv:Kalcija oksīds]] |
|||
[[nl:Calciumoxide]] |
|||
[[no:Kalsiumoksid]] |
|||
[[pl:Tlenek wapnia]] |
|||
[[pt:Cal]] |
|||
[[ro:Oxid de calciu]] |
|||
[[ru:Оксид кальция]] |
|||
[[simple:Calcium oxide]] |
|||
[[sk:Oxid vápenatý]] |
|||
[[sv:Kalciumoxid]] |
|||
[[tl:Calcium oxide]] |
|||
[[tr:Kalsiyum oksit]] |
|||
[[uk:Оксид кальцію]] |
|||
[[vi:Canxi ôxít]] |
|||
[[zh:氧化鈣]] |
|||
Aktuální verze z 25. 6. 2024, 06:01
| Oxid vápenatý | |
|---|---|
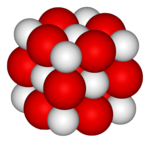 | |
 | |
| Obecné | |
| Systematický název | Oxid vápenatý |
| Triviální název | pálené vápno |
| Anglický název | Calcium oxide |
| Německý název | Calciumoxid |
| Sumární vzorec | CaO |
| Vzhled | bílá pevná práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 1305-78-8 |
| PubChem | 14778 |
| UN kód | 1910 |
| SMILES | [Ca]=O |
| Číslo RTECS | EW3100000 |
| Vlastnosti | |
| Molární hmotnost | 56,08 g/mol |
| Teplota tání | 2 580 °C |
| Teplota varu | 2 850 °C |
| Hustota | 3,316 g/cm³ |
| Index lomu | nD=1,837 |
| Rozpustnost ve vodě | 0,131 hm.% (0 °C) 0,123 hm.% (20 °C) 0,096 hm.% (50 °C) 0,05 hm.% (100 °C) |
| Měrná magnetická susceptibilita | −3,4×10−6 cm3 g−1 |
| Struktura | |
| Krystalová struktura | krychlová plošně centrovaná |
| Hrana krystalové mřížky | a= 481,08 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie | −635,07 kJ/mol |
| Entalpie tání | 1 343 J/g |
| Standardní molární entropie S° | 38,1 JK−1mol−1 |
| Standardní slučovací Gibbsova energie | −604,04 kJ/mol |
| Izobarické měrné teplo cp | 0,763 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R34, R36, R41 |
| S-věty | S2, S8, S22, S24/25, S26, S27, S28, S36/37/39 |
| NFPA 704 |  0
3
2
|
Některá data mohou pocházet z datové položky. | |
Oxid vápenatý (chemický vzorec CaO), triviálními názvy pálené vápno nebo též nehašené vápno je široce rozšířená běžně používaná chemická sloučenina. Oxid vápenatý je bílá žíravá a alkalická krystalická látka. Komerčně vyráběný oxid vápenatý také často obsahuje příměsi oxidu hořečnatého, oxidu křemičitého a malá množství oxidu hlinitého a oxidu železitého.[2]
Oxid vápenatý je obvykle vyráběn tepelným rozkladem hornin, jako je vápenec, který obsahuje uhličitan vápenatý (CaCO3 ve formě minerálů kalcitu a aragonitu). Rozklad je prováděn zahříváním jemně mleté horniny na teplotu přesahující 825 °C.[3] Tento proces je nazýván kalcinace nebo též pálení vápna. Uvolňuje se při něm oxid uhličitý (CO2) a uhličitan se přeměňuje na oxid vápenatý (CaO). Jako palivo se používá nejčastěji hnědé uhlí, koks, černé uhlí (respektive antracit) nebo zemní plyn. Dříve se jako palivo používalo též dřevo.
CaCO3 → CaO + CO2 |
|
Tento proces je reverzibilní, a proto od okamžiku, kdy je vypálené vápno ochlazeno, začíná vstřebávat okolní oxid uhličitý ze vzduchu a po čase se opět změní na původní uhličitan. Pálení vápna patří mezi první chemické procesy objevené člověkem již v pravěku.
Použití
[editovat | editovat zdroj]Jako hydratované nebo též triviálně hašené vápno ve formě hydroxidu vápenatého Ca(OH)2 (název tohoto minerálu je portlandit). Je využíván jako součást malty a sádry ke zvýšení tvrdosti materiálu. Příprava hašeného vápna je velmi jednoduchá, neboť oxid vápenatý je jeho zásaditý anhydrid a s vodou reaguje velmi rychle a exotermně.
CaO + H2O → Ca(OH)2
Historicky nejstarší využití vápna bylo ve stavebnictví – v omítkách je používali již starověcí Římané. Při nedostatku vápence kvůli tomu dokonce někdy byly rozbíjeny mramorové sochy.
Oxid vápenatý je též používán při výrobě skla a díky své schopnosti reagovat s křemičitany je používán v moderních postupech výroby ocelí a hořčíkových, hliníkových a jiných neželezných kovů. Napomáhá vyplavování nečistot do strusky.
Bývá také používán jako přísada pro úpravu vody. Snižuje její kyselost, změkčuje ji, funguje jako flokulant (sbaluje koloidní nečistoty) a napomáhá odstraňování fosfátů a jiných nečistot.
V papírnictví pomáhá rozpouštět lignin, působí jako koagulant a bělidlo.
V zemědělství a lesnictví snižuje kyselost půdy. Bývá též používán jako účinná složka při čistění a odsiřování plynných zplodin.
Tradičně bývá používán při pohřbívání mrtvých těl do otevřených hrobů zvláště v období epidemií například moru za účelem dezinfekce a zamezení zápachu rozkladu.
Ve forenzních vědách je používán k detekci otisků prstů. Jako dehydratační činidlo se používá k čištění kyseliny citronové, glukosy, barviv a jako pohlcovač CO2. Často bývá používán v hrnčířství, malířství a potravinářství.
Energie uvolněná reakcí oxidu vápenatého s vodou bývá používaná jako zdroj tepla k ohřevu speciálních samoohřevných konzerv jídla.
Roční světová produkce oxidu vápenatého je asi 130 milionů tun. Největší producenti, USA a Čína, vyprodukují každý přibližně 20 milionů tun.[4]
Využití ve stavebnictví
[editovat | editovat zdroj]Dle jakosti surovin lze vyrobit dva druhy vápna, které se ve stavebnictví technicky označuje jako tzv. vzdušné vápno.[5]
Druhy vzdušného vápna bílého
[editovat | editovat zdroj]| Označení | Značení | Obsah CaO + MgO 1 | Obsah MgO 1, 2 | Obsah SO3 1 |
|---|---|---|---|---|
| Bílé vápno 90 | CL90 | ≥90 | ≤5 | ≤2 |
| Bílé vápno 80 | CL80 | ≥80 | ≤5 | ≤2 |
| Bílé vápno 70 | CL70 | ≥70 | ≤5 | ≤2 |
| Doplňující třídění | Přípona |
|---|---|
| Nehašené vápno | Q |
| Hašené vápno bílé | S |
- Pozn.:
- 1 Hodnoty uvedené v hmotnostních %. Pro nehašené vápno platí přímo. U nehašeného vápna se vápenné kaše po odpočtu volné a vázané vody
- 2 Vyhoví-li zkoušce objemové stálosti dle ČSN EN 459 – 2, připouští se až 7%.
Druhy vzdušného vápna dolomitického
[editovat | editovat zdroj]| Označení | Značení | Obsah CaO + MgO 1 | Obsah MgO 1, 2 | Obsah SO3 1 |
|---|---|---|---|---|
| Dolomitické vápno 85 | DL85 | ≥85 | ≤30 | ≤2 |
| Dolomitické vápno 80 | DL80 | ≥80 | ≥5 | ≤2 |
| Doplňující třídění | Přípona |
|---|---|
| Polohašené vápno dolomitické | S1 |
| Plně hašené vápno dolomitické | S2 |
- Pozn.:
- 1 Hodnoty uvedené v hmotnostních %. Pro nehašené vápno platí přímo. U nehašeného vápna se vápenné kaše po odpočtu volné a vázané vody
- 2 Vyhoví-li zkoušce objemové stálosti dle ČSN EN 459 – 2, připouští se až 7%.
Reference
[editovat | editovat zdroj]- ↑ a b Calcium oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Oxid vápenatý - E 529. Doktorka.cz [online]. [cit. 2020-11-02]. Dostupné v archivu pořízeném z originálu dne 2020-11-09.
- ↑ Merck Index of chemicals and Drugs, 9th ed. monograph 1650
- ↑ http://indexmundi.com/en/commodities/minerals/lime/lime_t9.html
- ↑ Stavební materiály pro 1. roční SPŠ stavebních. M. Dědek, F. Vošický
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu oxid vápenatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu oxid vápenatý na Wikimedia Commons


