Dusulfura duklorido
| Dusulfura duklorido | |||||
 | |||||
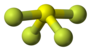
| Plata kemia strukturo de la Dusulfura duklorido | |||||
 | |||||
| Tridimensia kemia strukturo de la Dusulfura duklorido | |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 10025-67-9 | ||||
| ChemSpider kodo | 23192 | ||||
| PubChem-kodo | 24807 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | orflava, koroda, densa likvaĵo | ||||
| Molmaso | 135,02 g·mol-1 | ||||
| Denseco | 1,688g cm−3 | ||||
| Fandpunkto | −80 °C | ||||
| Bolpunkto | 137 °C | ||||
| Refrakta indico | 1,6587 | ||||
| Ekflama temperaturo | 118,5 °C | ||||
| Memsparka temperaturo | 234 °C | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 132 mg/kg (buŝe)[1] | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R14 R20 R25 R29 R35 R50 | ||||
| Sekureco | S(1/2) S26 S36/37/39 S45 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H301, H314, H332, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P260, P261, P264, P270, P271, P273, P280, P301+310, P301+330+331, P303+361+353, P304+312, P304+340, P305+351+338, P310, P321, P330, P363, P391, P405, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Dusulfura duklorido aŭ S2Cl2 estas kemia sulfura komponaĵo de kloro, orflava, koroda oleeca likvaĵo, uzata en kemiaj sintezoj kiel kloriga kaj sulfurigagento. Dusulfura duklorido estas neakordigebla kun hidrokarbonidoj, fosforaj oksidoj, akvo, peroksidoj, metaloj kaj oksidigantoj. Ĝi estas solvebla en alkoholoj, benzeno, etero, kloroformo kaj karbona tetraklorido.
Dusulfura duklorido estas kapabla dissolvi grandajn kvantojn da sulfuro, kaj do ĝi estas uzata en la vulkanizado de kruda kaŭĉuko. Kaj S2Cl2 kaj SCl2 povas esti uzataj en la sintezo de neorganikaj sulfuraj komponaĵoj (tiaj kiaj SOCl2 kaj SF4) kaj por sulfurigaj kaj klorigaj reakcioj. Dusulfura duklorido facile aldonas al organikaj duoblaj ligaĵoj, ekzemple, ĝi reakcias kun etileno por formi mustardan gason, kiu iam estis uzata kiel kemia armilo.[3]
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]Sintezo 2
[redakti | redakti fonton]- Preparado per interagado de karbona disulfido kaj klorgaso. Zorgu, la merkaptano produktita povas malkomponiĝi en karbona tetraklorido kaj sulfuro:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Dusulfura duklorido reakcias kun akvo por doni sulfidan acidon, sulfuran duoksidon kaj kloridan acidon:
Reakcio 2
[redakti | redakti fonton]- Reakcio kun benzeno donante difenil-sulfidon (CAS-numero 139-66-2), kloridan acidon kaj sulfuron:
Reakcio 3
[redakti | redakti fonton]- Metil-natrio reakcias kun dusulfura duklorido por formi dimetilan sulfidon kaj natrian kloridon:
Reakcio 4
[redakti | redakti fonton]- Dusulfura duklorido reakcias kun amonia klorido por formi tetrasulfuran tetranitridon, sulfuron, kaj kloridan acidon:
Reakcio 5
[redakti | redakti fonton]- Preparado de mustarda gaso per reakcio kun etileno:[4]
Reakcio 6
[redakti | redakti fonton]- Dusulfura duklorido reakcias kun kalia fluorosulfato por formi disulfuran difluoridon, sulfuran trioksidon kaj kalian kloridon:
Reakcio 7
[redakti | redakti fonton]- Preparado de sulfura kvarfluorido per interagado de dusulfura duklorido kaj fluorida acido en ĉeesto de acetonitrilo:[5]
Reakcio 8
[redakti | redakti fonton]- Dusulfura duklorido eksplode atakas aluminion formante aluminian trikloridon en ĉeesto de acetata anhidrido:[6]
Vidu ankaŭ
[redakti | redakti fonton]Literaturo
[redakti | redakti fonton]- Merck Millipore
- Handbook of Emergency Chemical Management
- Industrial Inorganic Chemistry
- Sulfur Extrusion Reactions: Scope And Mechanistic Aspects
- Synthetic Methods of Organometallic and Inorganic Chemistry
- Reag.paperplane










![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{240^{o}C}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/818883c73e8a685f34f0eed6524164ace50bab82)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{I_{2}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2541a46938e301e6500878eefa39c56eda8d2ce7)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)

![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{AlCl_{3}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a42b2d1e60044dbf397a738ad540d0ddd89d384a)



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{Acetonitrilo}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e94c6072f4fb514b554c0e91936a9e0d5320abc)