Hidrogeno lotura


Hidrogeno lotura (batzuetan era okerrean hidrogeno zubi deitua) atomo edo talde elektronegatibo batekin [normalean nitrogenoarekin (N), oxigenoarekin (O) edo fluorrarekin (F)] kobalenteki lotuta dagoen hidrogeno atomo baten (H) eta elektroi bikote ez lotzaile bat duen beste atomo elektronegatibo baten (normalean nitrogenoa, oxigenoa edo fluorra) arteko erakarpen indar elektrostatiko bat da. Lotura mota honetan hidrogenoa duen taldeari hidrogeno lotura emaile (donor, Dn) deitzen zaio eta elektroi bikote ez lotzailea duenari hidrogeno lotura hartzaile (acceptor, Ac) deritzo. IUPAC erakundearen arabera elkarrekintza hau Dn-H···Ac bezala adieraztea gomendatzen da, non zuzen jarraiak lotura kobalentea adierazten duen eta zuzen ez jarraiak hidrogeno lotura.[1] Dipolo-dipolo indar elektrostatikoetan oinarritzen den molekularteko indar bat da baina gaur egungo ebidentziek, lotura honen izaera, elkarrekintza kobalentearekin lotuago dagoela ikusi dute.[2]
Lotura hauek intermolekularrak (bananduta dauden molekulen artekoak) edo intramolekularrak (molekula berdineko taldeen artean) izan daitezke.[3][4][5][6] Atomo emaileen edo hartzaileen izaeraren, geometriaren eta ingurunearen arabera hidrogeno loturaren energia 1 eta 40 kcal/mol artekoa izan daiteke.[7] Beraz van der Waals dipolo-dipolo indarrak baino sendoagoak eta lotura guztiz kobalente edo ionikoak baino ahulagoak dira. Lotura mota hauek molekula ez-organikoetan (uraren egituran) zein organikoetan (ADNearen egituran) ager daitezke.
Nitrogenoa, oxigenoa eta fluorra duten molekulen propietate fisiko eta propietate kimiko ez ohiko asko hidrogeno loturen bidez azaldu da. Adibidez, tabla periodikoko 16. taldeko hidruroen irakite puntuak konparatzean uraren irakite puntua altuegia da (100 °C), molekulen arteko hidrogeno loturen ondorio.[8] Molekula barneko hidrogeno loturak aldiz, proteinen bigarren eta hirugarren mailako egituren erantzuleak dira.
Tradizionalki nitrogenoari, oxigenoari eta fluorrari lotutako ezaugarri berezi bat bezala aztertu da baina hidrogeno lotura ahulenak sufrearekin, kloroarekin edota karbonoarekin lotuta dauden hidrogenoek egiten dituztela ikusi da.[9] Atomo hauek hidrogeno lotura emale edo hartzaile bezala joka dezakete, bereziki karbonoaren inguruko atomorenbat oso elektronegatiboa denean (kloroformoan, aldehidoetan edo azetileno terminaletan adibidez).[10][11]

Pixkanaka N, O eta F atomoak ez diren hidrogeno lotura emaile ahul gehiago onartuz joan dira, hidrogenoarekin elektronegatibotasun diferentzia ez oso handiak dituztenak. Elkarreragin ez tradizional hauek oso ahulak diren arren (~1kcal/mol), garrantzitsuak dira eta aztertuak eta onartuak izan dira adibidez kimika farmazeutikoan errezeptore-ligando motako elkarrekintzetan edo materialen zientzian intra/intermolekularrak diren elkarrekintzetan. Horregatik hidrogeno loturen definizioa handitzen joan da lotura ahul hauek kontuan izateko. IUPACeko lankide batzuk, 2011an definizio berritu bat argitaratu zuen Pure and Applied Chemistry aldizkarian:
"The hydrogen bond is an attractive interaction between a hydrogen atom from a molecule or a molecular fragment X–H in which X is more electronegative than H, and an atom or a group of atoms in the same or a different molecule, in which there is evidence of bond formation."[12]
Hidrogeno lotura, lotura baten eraketaren frogaren bat dagoen, X-H motako molekula edo fragmentu molekular bateko eta molekula berdineko edo desberdineko atomo baten edo atomo batzuen arteko elkarrekintza erakargarri bat da non X hidrogenoa baino elektronegatiboagoa den atomo bat den.

Irizpide zerrenda luze eta zehatz baten parte, IUPACek elkarrekintza erakargarria elektrostatikarengatik (multipolar-multipolar edo multipolar-induzitu multipolar elkarrekintzak), kobalentziarengatik (orbitalaren gainezarpenagatiko karga transferentzia) eta dispertsioarengatik (London indarrak) sortzen dela azaldu du eta sistema bakoitzaren arabera irizpide bakoitzak garrantzia erlatibo handiagoa duela. Hala ere, dispertsio indarrak garrantzitsuak diren kasuak irizpide honetatik kanpo uztea gomendatzen da, Ar---CH4 eta CH4---CH4 motako sistemak adibidez.[1]
Hala ere, oraindik liburu gehienetan hidrogeno loturen definizioa modu tradizionalean ematen da, hidrogeno elektropositibo eta nitrogeno, oxigeno edo fluor elektronegatibo baten arteko lotura dela esanez eta elektronegatibotasunarekin arrazoituz.
Hidrogeno lotura sinpleena ur molekulan dago. Ur molekula batek bi hidrogeno atomo eta oxigeno atomo bat ditu. Bi ur molekulek hidrogeno lotura bat era dezakete, hau ur dimeroa bezala ezagutzen da eta eredu moduan erabiltzen da. Zenbat eta molekula gehiago egon, ur likidoaren kasuan bezala, lotura gehiago dira posible ur molekulako oxigenoak bi elektroi pare dituelako aske. Oxigenoaren elektroi pare bakoitzak beste bi ur molekuletako hidrogeno atomoekin loturak era ditzake. Beraz, ur molekula bakoitza beste lau molekulei elkar daiteke (oxigenoaren elektroiei libreei esker bi molekuletara eta hidrogeno atomoei esker beste bitara).
Erabilera okerra: "Hidrogeno lotura" edo "hidrogeno zubia"
[aldatu | aldatu iturburu kodea]Oso ohikoa da "hidrogeno lotura" esan beharrean "hidrogeno zubi" hitza erabiltzea baina erabilera okerra da. Akats hau hizkuntza askotara hedatu da (gaztelaniara, frantsesera, katalanera...) baina kimikariek nahiago izaten dute "hidrogeno lotura" hitza erabili. IUPACen arabera, hydrogen bond esaten da eta gainontzeko hizkuntzetan itzulera zuzena egin behar da, hots, hidrogeno lotura.
Kimikan hidrogeno zubiak beste esan nahi bat du.[13] Adibide bezala boranoen kasua azalduko da, bertan hidrogeno zubiak gertatzen baitira.
Boranoak hidrogenoz eta boroz osatutako konposatu kimikoak dira. Formula kimiko sinpleena duen boranoa BH3 da ez da egonkorra eta diboranoaren deskonposaketan sortu eta oso azkar desagertzen da, ez-egonkorra baita ( 2B2H6 = BH3 + B3H9). Borano handiagoak ere badaude, adibidez B2H6, B4H10, B9H15, B10H14, B20H16. Boranoak oso erabilgarriak dira erreakzioak egiteko. Hidrogenoa boroa baino elektronegatiboagoa denez hidrogenoak karga partzial negatibo handia du.

Gainerako hidruroekin konparatuz boranoak ez ohiko egitura dute. Egitura hauetan elektroiak kontatzen baditugu ezin dira bi elektroi bi atomoren artean partekatu eta beraien egitura ezin da lotura kobalente normalez azaldu(2c-2e motako lotura, non "e" elektroi kantitatea den eta "c" loturan parte hartzen duen atomo kantitatea). Hau azaltzeko lotura polizentratuaren kontzeptua sortu zen, horrela elektroi parea bi atomoren artean egon ordez hiru atomoren artean deslokalizatuta dago. Horrela hidrogeno zubiaren kontzeptua sortu zen eta ez dauka zerikusirik hidrogeno loturekin.
Diboranoaren kasu hau grafikoki hobeto azaltzeko ikusi eskubitara dagoen diboranoaren egitura. Bertan ikusi daiteke boro bakoitzak lau lotura egiten dituela, bi lotura kobalente 2c-2e (BH moduan) eta beste bi lotura kobalente 3c-2e (BHB moduan, hidrogeno honi hidrogeno zubi deitzen zaio). Kontuan izan behar da borano handiagoen loturak azaltzeko lotura mota gehiago erabiltzen direla, guztira bost lotura mota gerta daitezke borano handietan:[14][15][16]
- BH lotura = 2c-2e Boro-hidrogeno lotura terminala
- BHB lotura = 3c-2e Hidrogeno zubi bidezko lotura
- BB lotura = 2c‑2e Boro-boro lotura
- BBB lotura irekia = 3c-2e Boro zubi ireki bidezko lotura
- BBB lotura itxita = 3c-2e Boro itxi bidezko lotura
Bost lotura hauek erabiliz borano guztien egiturak eta loturak azal daitezke. Hau gutzia hobeto azaltzeko orbital molekularren (O.M.) teoria erabili da.
Azalpen honen helburua hidrogeno loturen eta hidrogeno zubien arteko desberdintasun zehatza zein den ondo azaltzea izan da. Ondorengo taulan hidrogeno zubien eta hidrogeno loturen arteko diferentziak ikusi daitezke.
| Formula kimikoa | 3D irudia | |||
|---|---|---|---|---|
| Hidrogeno zubia |  |
 | ||
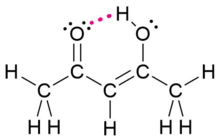
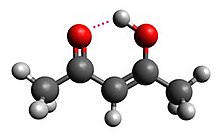
| Hidrogeno lotura | Intermolekularra |  |
 | |
| Intramolekularra |  |
 |
 | |
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ a b Arunan, Elangannan; Desiraju, Gautam R.; Klein, Roger A.; Sadlej, Joanna; Scheiner, Steve; Alkorta, Ibon; Clary, David C.; Crabtree, Robert H.; Dannenberg, Joseph J. (2011-07-08). "Definition of the hydrogen bond (IUPAC Recommendations 2011)". Pure and Applied Chemistry. 83 (8): 1637–1641. doi:10.1351/PAC-REC-10-01-02. ISSN 1365-3075
- ↑ Weinhold, Frank; Klein, Roger A. (2014). "What is a hydrogen bond? Resonance covalency in the supramolecular domain". Chemistry Education Research and Practice. 15: 276–285. doi:10.1039/c4rp00030g.
- ↑ Pimentel, G. The Hydrogen Bond Franklin Classics, 2018), ISBN 0343171600
- ↑ Jeffrey, G. A.; An introduction to hydrogen bonding; Oxford university press New York, 1997. ISBN 0195095499
- ↑ Jeffrey, G. A.; Saenger, W. Hydrogen bonding in biological structures; Springer: Berlin, 1994, 2012 Springer; ISBN 3540579036
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "hydrogen bond". doi:10.1351/goldbook.H02899
- ↑ Steiner, Thomas (2002). "The Hydrogen Bond in the Solid State". Angew. Chem. Int. Ed.41: 48–76. doi:10.1002/1521-3773(20020104)41:1<48::AID-ANIE48>3.0.CO;2-U.
- ↑ Sabin, John R. (1971). "Hydrogen bonds involving sulfur. I. Hydrogen sulfide dimer". J. Am. Chem. Soc. 93 (15): 3613–3620. doi:10.1021/ja00744a012
- ↑ Desiraju, G. R. and Steiner, T. The Weak Hydrogen Bond: In Structural Chemistry and Biology , International Union of Crystallography;2001, ISBN 0198509707
- ↑ Nishio, M.; Hirota, M.; Umezawa, Y. The CH–
π Interactions; Wiley-VCH, New York, 1998. • Wiley-VCH; 1998) ISBN 0471252905 - ↑ Nishio, M (2011). "The CH/[small pi] hydrogen bond in chemistry. "Title". Phys. Chem. Chem. Phys. 13: 13873–13900. doi:10.1039/c1cp20404a.
- ↑ Arunan, Elangannan; Desiraju, Gautam R.; Klein, Roger A.; Sadlej, Joanna; Scheiner, Steve; Alkorta, Ibon; Clary, David C.; Crabtree, Robert H.; Dannenberg, Joseph J.; Hobza, Pavel; Kjaergaard, Henrik G.; Legon, Anthony C.; Mennucci, Benedetta; Nesbitt, David J. (2011). "Definition of the hydrogen bond". Pure Appl. Chem. 83 (8): 1637–1641. doi:10.1351/PAC-REC-10-01-02
- ↑ Brown, H. C., Boranes in Organic Chemistry, Comell University Press, 1972.
- ↑ Muetterties, E. L., ed., The Chemistry of Boron and its Compounds, Wiley, 1967
- ↑ Boscke, F., ed., New Results in Boron Chemistry, Fortschritte der Chemischen Forschung, Springer Verlag, 1971
- ↑ Muetterties, E. L. y Knoth, W. H., Polyhedral Boranes, Dekker, 1968


