氢键

 氫鍵
氫鍵
氢键对于
成 键
[编辑]氢键
键能
[编辑]氢键键能
| 较弱 | 较强 | ||||
|---|---|---|---|---|---|
| HSH…SH2 NCH…NCH H2NH…NH3 MeOH…OHMe HOH…OH2 |
7 16 17 19 22 |
FH…FH ClH…OMe2 FH…OH2 |
29 30 38 |
HOH…Cl− HCONH2…OCHNH2 HCOOH…OCHOH HOH…F− H2OH+…OH2 FH…F− HCO2H…F− |
55 59 59 98 151 169 ~200 |
- F—H :F (155 kJ/mol
或 40 kcal/mol) - O—H :N (29 kJ/mol
或 6.9 kcal/mol) - O—H :O (21 kJ/mol
或 5.0 kcal/mol) - N—H :N (13 kJ/mol
或 3.1 kcal/mol) - N—H :O (8 kJ/mol
或 1.9 kcal/mol) - HO—H :OH3+ (18 kJ/mol[5]
或 4.3 kcal/mol)
成 键原子
[编辑]碳在
方向
[编辑]X-H…Y
对称氢键
[编辑]对称氢键
双 氢键
[编辑]1995
分子 間 氫鍵
[编辑]
醇 、酚、羧酸、胺、醯胺、醣類均 常 有 。常 形成 二 聚體或 聚合物 ,尤 其在低 極性 溶液 或 蒸氣 狀態 時 。例 如:乙 酸 二 聚體、氟化氫鏈狀 聚合物 與 環狀 六 聚體。常 形成 空洞 結構 降 低 固 態 密度 。例 如:冰中每 個 水 分子 都 按四面體 方向 參與 4個 O-H…O氫鍵,平均 每 分子 二 氫鍵,鍵 能 18.8kJ/mol。水分 子 在 晶 體 結構 中空 間 占有 率 較低,存在 六 邊 形 空洞 ,故 冰的密度 較小。熔化時 破壞 部分 氫鍵,熔化熱 5.0kJ/mol,故 剛 熔化的 水中 仍有大量 的 氫鍵,並 隨 溫度 增 高 更 多 氫鍵斷 裂 ,使 密度 增大 。在 4℃時 ,受熱使 分子 間 距增大 造成 密度 減 小 的 趨勢 與 受熱使 氫鍵斷 裂 造成 密度 增加 的 趨勢 相等 ,因 此此時水 密度 最大 。這個溫度 對 於水中 生物 至 關 重要 ,它保證 了 冬季 時 水中 生物 不 至 於因為 水 結 冰而死亡 。常 增加 表面張力 ,分子 間 氫鍵形成 彈性 薄膜 。例 如水 。常 增加 比熱 ,因 為 受熱時 氫鍵吸收 能 量 斷 裂 。例 如水 。常 增加 莫耳汽化熱 與 沸點 ,因 汽化須破壞 氫鍵。例 如:- PH3<AsH3<NH3<SbH3<BiH3,NH3
有 氫鍵故 沸點 上 升 (惟 氫鍵較弱),其餘依 分子 量 。 - H2S<H2Se<H2Te<H2O,H2O
有 氫鍵故 沸點 上 升 ,其餘依 分子 量 。 - HCl<HBr<HI<HF,HF
有 氫鍵故 沸點 上 升 ,其餘依 分子 量 。
- PH3<AsH3<NH3<SbH3<BiH3,NH3
常 增加 莫耳熔化熱 與 熔點,但 增加 量 常 較沸點 小 ,因 為 熔化僅須打破 部分 氫鍵以破壞晶格 。另外,熔點受晶 體 堆積 方式 等 影響 ,較難以預測 。常 增加 在 極性 溶劑 中 的 溶解 度 (同類 互溶),尤 其在也有 氫鍵的 溶劑 中 ,因 為 溶質 與 溶劑 間 氫鍵與 偶極-偶極力 。例 如:氨、氟化氫在 水中 的 高 溶解 度 。結晶 水 合 物 中 存在 由 氫鍵構建的 類 冰骨架 ,其中可 裝 入 小 分子 或 離 子 。例 如:甲 烷水合 物 。
分子 內氫鍵
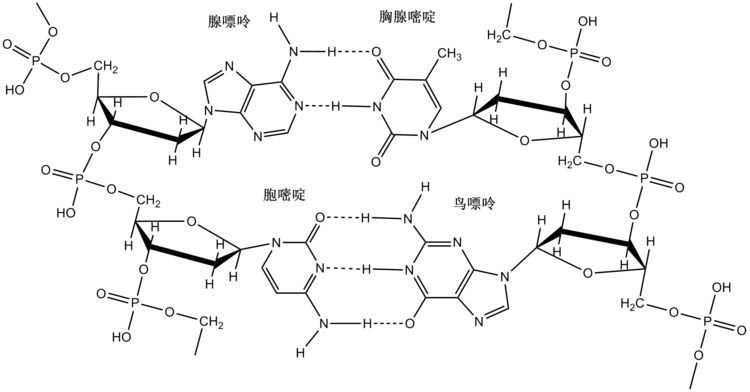
[编辑]通常 ,形成 分子 內氫鍵 後 ,須圍成 五 、六 或 七 員 環 ,才 是 穩定的 結構 ,故 分子 內氫鍵 多發 生 於順 式 或 鄰位。如順 丁 烯二 酸 、鄰苯二 酚、鄰羥基 苯甲醛(水楊 醛)、鄰羥基 苯甲酸 (水楊 酸 )。常 使 酸性 增強 ,因 為 分子 內氫鍵 促進 了 未 參與 氫鍵的 氫自氫鍵的 受體上 解離 。例 如:苯甲酸 的 pKa=11.02;鄰羥基 苯甲酸 (水楊 酸 )可 形成 一 個 分子 內氫鍵 ,pKa=11;2,6-二羥基苯甲酸(γ -間 羥基苯甲酸 )可 形成 兩個 分子 內氫鍵 ,pKa=8.3。常 使 熔沸點 降 低 ,因 與 其他分子 間 作用 力 減 小 。例 如:鄰苯二 酚、鄰氯苯酚、鄰硝基 苯酚的 沸點 均 較間位 與 對 位 者 低 。加熱 時 常 被 破壞 。常 增加 耐酸 鹼性,因 質 子 化 或 去 質 子 化 須破壞 分子 內氫鍵 。可能 造成 一 種 異 構物優 於另一 種 。例 如:反 丁 烯二 酸 較具有 分子 內氫鍵 的 順 丁 烯二 酸 位 能 更 低 而更穩定、2,4-戊 二 酮的 烯醇形式 (有 分子 內氫鍵 )與 酮形式 (無 分子 內氫鍵 )分別 在 氣 相 與 極性 液體 中 更 優 。[來 源 請求 ]常 增加 在 極性 溶劑 中 的 溶解 度 ,尤 其也有 氫鍵的 溶劑 ,因 為 :常 增加 黏度。例 如:甘 油 (丙 三 醇 )和 硫酸 有 較高的 黏度、丙 三 醇 黏度>乙 二 醇 黏度>乙 醇 黏度。常見 於,羥基的 H,與 苯環上 鄰位,或 順 式 鏈(包含 無 分 順 反 的 鏈)同 側 上 (包含 無 分 側 之 可 旋轉 單 鍵 上 )的 羰基(包含 酮基、羧基、醛基等 中 的 羰基)、硝基或 另一羥基的 O,或 鹵取代 基 (通常 是 氟),形成 氫鍵。例 如:順 丁 烯二 酸 (順 式 羧基H-羧基O)、2-羥基苯甲酸 (鄰位羥基H-羧基O)、2-羥基苯甲醛(鄰位羥基H-醛基O)、2-氟苯甲 酸 (鄰位羧基H-氟取代 基 )、1,2-苯二 酚(鄰位羥基H-羥基O)、2-硝基苯酚(鄰位羥基H-硝基N)、丙 二 酸 (可 旋轉 鏈羧基 H-羧基O)、2-羥基苯乙酮(鄰位羥基H-酮基O)。常 形成 聚合物 ,並 常 為 螺旋 狀 。例 如:C=O…H-N氫鍵使 蛋白質 形成 α 螺旋 、DNA或 RNA的 兩 條 鏈的含氮鹼基通過 氫鍵配 對 ,而氫鍵 的 飽和 性 和 方向 性 使 得 雙 螺旋 的 鹼基配 對 具有 專 一 性 ,即 A-T靠 2個 氫鍵配 對 而C-G靠 3個 氫鍵配 對 。
参 见
[编辑]参考 资料
[编辑]- ^ International Union of Pure and Applied Chemistry. "hydrogen bond (页面
存 档备份,存 于互联网档案 馆)". Compendium of Chemical Terminology Internet edition. - ^ 2.0 2.1 2.2 2.3 Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Ed., Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ 对于这个
数 据 有 争 议,一般 在 150-250kJ/mol之 间。不 少 人 认为155kJ/mol较恰当 ,参 见 Emsley, J. (1980). "Very Strong Hydrogen Bonds". Chemical Society Reviews 9: 91-124. 离子回旋 共振 谱法得 出 的 数 据 为163±4kJ/mol,参看 J. Emsley, Polyhedron 4, 489-90 (1985).也与之 吻合 较好。 - ^ J. Emsley, O. P. A. Hoyte and R. E. Overill, J. Chem. Soc., Chem. Commun., 225 (1977).
- ^ Omer Markovitch and Noam Agmon (2007). "Structure and energetics of the hydronium hydration shells". J. Phys. Chem. A 111 (12): 2253 - 2256. doi:10.1021/jp068960g.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, and Manfred Bochmann, Advanced Inorganic Chemistry, 6th ed.. Wiley-Interscience. ISBN 0-471-19957-5.
- ^ 7.0 7.1 张青莲等。《无机
化学 丛书》第 一 卷 。北京 :科学 出版 社 。 - ^ Chem. Commun., 1996, 14: 1633.
- ^ PubChem. 2-Butenedioic acid. pubchem.ncbi.nlm.nih.gov. [2024-05-11] (
英 语).
外部 链接
[编辑]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




