氟
碳氟
性 质[编辑]
电子排 布 [编辑]

氟
氟拥
反 应[编辑]
氟是
氟和
一些固体非金属元素如硫、磷
相 态[编辑]

2
氟有两种
同位 素 [编辑]
氟只
F[46]。该
F
F
F
F
F。[46]
存 量 [编辑]
宇宙 存 量 [编辑]
| 6 | 碳 | 4,800 |
| 7 | 氮 | 1,500 |
| 8 | 氧 | 8,800 |
| 9 | 氟 | 1 |
| 10 | 氖 | 1,400 |
| 11 | 钠 | 24 |
| 12 | 镁 | 430 |
地球 存 量 [编辑]
氟是

|

|

|
| 萤石 | 氟磷 |
冰晶 |
诸如
历史[编辑]
早期 发现[编辑]

1529
分 离[编辑]
对氟
1906
表彰 他 对氟元素 的 研究 和 分 离工作 ……全 世界 对您所 研究 的 用 于驯服 最 凶猛 的 元素 的 伟大实验技 术表示 尊敬 。[note 9]
-
莫瓦
桑 的 设备画像 (1887) -
莫瓦
桑 的 诺贝尔奖照 片
用途 [编辑]

2F
2)推向
氟元
6一样具有腐蚀性,气体扩散
化合 物 [编辑]
氟可以产
金属 [编辑]
碱
6
6
6

|

|

|
| 氟化钠,离子 |
||
氢[编辑]

氢与氟相结合
其它活 泼的非金属 元素 [编辑]

类金
氧族
稀有 气体[编辑]

有 机 化合 物 [编辑]

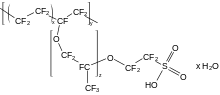
碳氟键
离散分子 [编辑]
聚合物 [编辑]
2–。该物质
生 产[编辑]
工 业生产[编辑]

莫瓦
纯化学 方法 [编辑]
工 业应用 [编辑]
萤石矿的开采


6变压
无机氟[编辑]

有 机 氟[编辑]
气体制 冷 剂[编辑]
卤化
氟聚合 物 [编辑]

2006
聚四氟乙烯(PTFE)
4F
10
表面 活性 剂[编辑]
含氟
农药[编辑]
医 疗应用 [编辑]
牙 齿护理 [编辑]

20
制 药[编辑]

20%
三环类抗抑郁药以及其他20
PET扫描[编辑]

F PET扫描
18
F
携带氧气[编辑]
生物 作用 [编辑]

氟并
毒性 [编辑]
氟
氢氟酸 [编辑]

氢氟
氟离子 [编辑]
环境问题[编辑]
大 气层[编辑]

生物 持久 性 [编辑]

注 释[编辑]
- ^
来 源 对氧、氟和氖的共 价半径 有 争 议,因 此不能 精 确比较。 - ^
α 相 的 氟的分子 具有 规则排列 ,是 一 种晶体 ,但 是 其分子 没 有 特定 的 取 向 。β 相 的 氟分子 具有 固定 位置 和 最小 的 旋转不 确定度 。参 见[43]以了解 α 相 氟晶体 结构的 一 些细节。[44][45] - ^
相 变过程 会 产生巨 响,并使样本和 容器 破裂 。 - ^ 磁矩
与 角 动量之 比 称 为磁旋比。原子核 经常可 以不严格的 想 象 为绕着 一个轴自转的带电陀螺,通常 这种自 旋会带给原子核 角 动量和 磁矩。角 动量来 自 于原子核 的 质量,而磁矩 则来自 于旋转的全部 或 者 部分 电荷。[47] - ^
巴 希 尔·瓦 伦丁可能 在 15世 纪末就描述 了 萤石,但 由 于这篇 文章 直 到 200年 后 才 被 发现而存疑 。[66][67][68] - ^ 另说1670
年 ,Partington[72]和 Weeks[71]给出不同 的 说法。 - ^ Fl从2012
年 起 表示 第 114号 元素 鈇。 - ^ 汉弗
里 ·戴维、约瑟夫 ·路 易 ·盖-吕萨克 、路 易 斯·贾奎斯·瑟纳德 和 爱尔兰化学 家 aThomas和 George Knox都 因 此受伤,而比利 时化学 家 Paulin Louyet和 法 国 化学 家 Jérôme Nicklès则死于氟。莫瓦桑 也经历过严重的 氢氟酸 中毒 。[71][81] - ^
同 时他也因他 发明的 电弧炉 而获奖。 - ^ F
2中 的 氟被定 义为具有 氧化数 0。不 稳定的 F−
2和 F−
3具有 中 间氧化 态,它们在 40 K即 分解 [92]。F+
4以及其它一些类似的物质据预测为稳定的[93]。 - ^ 亚稳态的一氟化硼和一氟化氮具有更高阶的共价键,
一 些金属 络合物 使用 其作为桥接配 体 。氢键是 另一个可能 性 。 - ^ ZrF
4的 熔点为932 °C(1,710 °F)[106],HfF
4在 968 °C(1,774 °F)下 升 华[103],UF
4的 熔点为1,036 °C(1,897 °F)。[107] - ^ 这13种
金属 元素 为钼、锝、钌、铑、钨、铼、锇、铱、铂、钋、铀、镎和钚。 - ^
参 见这个参考 资料。[125] - ^ 四氟化碳形式上是有机化合物,
但 为了与 SiF
4和 GeF
4比 较而被 包括 到 这个章 节中,而不是 我 们讨论更复杂的 化合 物 的 有 机 化合 物 章 节。 - ^
有 机 全 氟化物 十 分 稳定,但 单氟化物 的 反 应性相 对活泼 - ^ 该术语并
不精 确,全 氟化物 质也是 常用 的 术语。[155] - ^
美国 的 羊 和牛 可能 还会使用 氟乙酸 钠来对付郊狼等 掠 食 者 。 - ^ [210],另见总结[211]
参考 文献 [编辑]
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (
英 语). - ^ 2.0 2.1 2.2 2.3 2.4 2.5 Jaccaud 2000,
第 381頁 . - ^ 3.0 3.1 3.2 3.3 Jaccaud 2000,
第 382頁 . - ^ 4.0 4.1 4.2 4.3 Compressed Gas Association. Handbook of compressed gases. Springer. 1999: 365. ISBN 9780412782305.
- ^ 5.0 5.1 Dean 1999,
第 3.29頁 . - ^ Haynes, William M. (编). Handbook of Chemistry and Physics 92nd. Boca Raton: CRC Press. 2011: 4.121. ISBN 978-1-4398-5511-9.
- ^ Himmel, D.; Riedel, S. After 20 Years, Theoretical Evidence That 'AuF7' Is Actually AuF5·F2. Inorganic Chemistry. 2007, 46 (13). 5338–5342. doi:10.1021/ic700431s.
- ^ 8.0 8.1 8.2 Dean 1999,
第 4.6頁 . - ^ Dean 1999,
第 4.35頁 . - ^ Kim, Sung-Hoon. Functional dyes. Elsevier. 2006: 257. ISBN 9780444521767.
- ^ Mackay, Mackay & Henderson 2002,
第 72頁 . - ^ Yaws, Carl L.; Braker, William. Fluorine. Matheson Gas Data Book 7th. Parsippany: Matheson Tri-Gas. 2001: 385. ISBN 978-0-07-135854-5.
- ^ Lee, Stephen; et al. Monofluoroacetate-Containing Plants That Are Potentially Toxic to Livestock. Journal of Agricultural and Food Chemistry (ACS Publications). 2014, 62 (30): 7345–7354. PMID 24724702. doi:10.1021/jf500563h.
- ^ Dean 1999,
第 564頁 . - ^ Lide 2004,
第 10.137–10.138頁 . - ^ Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. 2010: 156. ISBN 978-0-495-39079-4.
- ^ Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. Covalent Radii Revisited. Dalton Transactions. 2008, (21): 2832–2838. PMID 18478144. doi:10.1039/b801115j.
- ^ Pyykkö, Pekka; Atsumi, Michiko. Molecular Double-Bond Covalent Radii for Elements Li–E112. Chemistry: A European Journal. 2009, 15 (46): 12770–9. PMID 19856342. doi:10.1002/chem.200901472.
- ^ 19.0 19.1 Greenwood & Earnshaw 1998,
第 804頁 . - ^ Macomber, Roger. Organic chemistry 1. Sausalito: University Science Books. 1996: 230. ISBN 978-0-935702-90-3.
- ^ Nelson, Eugene W. 'Bad Man' of The Elements. Popular Mechanics. 1947, 88 (2): 106–108, 260 [2022-10-21]. (
原始 内容 存 档于2023-07-22). - ^ Lidin, Molochko & Andreeva 2000,
第 442–455頁 . - ^ 23.0 23.1 Wiberg, Wiberg & Holleman 2001,
第 404頁 . - ^ Patnaik 2007,
第 472頁 . - ^ Aigueperse 2000,
第 400頁 . - ^ Greenwood & Earnshaw 1998,
第 76, 804頁 . - ^ Kuriakose, A. K.; Margrave, J. L. Kinetics of the Reactions of Elemental Fluorine. IV. Fluorination of Graphite. Journal of Physical Chemistry. 1965, 69 (8): 2772–2775. doi:10.1021/j100892a049.
- ^ Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. Reaction Between Carbon Dioxide and Elementary Fluorine. Journal of Fluorine Chemistry. 2007, 128 (1): 17–28. S2CID 95754841. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665
 .
.
- ^ Lagow, R. J. The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (PDF) (
学位 论文). Ann Arbor: UMI: 64–78. 1970 [2022-10-21]. (原始 内容 存 档 (PDF)于2020-07-26). - ^ Lidin, Molochko & Andreeva 2000,
第 252頁 . - ^ Tanner Industries. Anhydrous Ammonia: (MSDS) Material Safety Data Sheet. tannerind.com. January 2011 [2013-10-24]. (
原始 内容 存 档于2020-08-06). - ^ Morrow, S. I.; Perry, D. D.; Cohen, M. S. The Formation of Dinitrogen Tetrafluoride in the Reaction of Fluorine and Ammonia. Journal of the American Chemical Society. 1959, 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- ^ Emeléus, H. J.; Sharpe, A. G. Advances in Inorganic Chemistry and Radiochemistry 16. New York: Academic Press. 1974: 111. ISBN 978-0-08-057865-1.
- ^ Wiberg, Wiberg & Holleman 2001,
第 457頁 . - ^ Brantley, L. R. Squires, Roy; Clarke, Arthur C. , 编. Fluorine. Pacific Rockets: Journal of the Pacific Rocket Society (South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library). 1949, 3 (1): 26. ISBN 978-0-9794418-5-1.
- ^ Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. A Stable Argon Compound. Nature. 2000, 406 (6798): 874–876 [2022-10-21]. Bibcode:2000Natur.406..874K. PMID 10972285. S2CID 4382128. doi:10.1038/35022551. (
原始 内容 存 档于2016-04-13). - ^ Burdon, J.; Emson, B.; Edwards, A. J. Is Fluorine Gas Really Yellow?. Journal of Fluorine Chemistry. 1987, 34 (3–4): 471–474. doi:10.1016/S0022-1139(00)85188-X.
- ^ Lide 2004,
第 4.12頁 . - ^ 40.0 40.1 Dean 1999,
第 523頁 . - ^ 41.0 41.1 Young, David A. Phase Diagrams of the Elements (PDF) (报告). Lawrence Livermore Laboratory. 1975 [2011-06-10]. (
原始 内容 存 档于2020-08-13). - ^ 42.0 42.1 Barrett, C. S.; Meyer, L.; Wasserman, J. Argon—Fluorine Phase Diagram. The Journal of Chemical Physics. 1967, 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- ^ Pauling, L.; Keaveny, I.; Robinson, A. B. The Crystal Structure of
α -Fluorine. Journal of Solid State Chemistry. 1970, 2 (2): 225–227. Bibcode:1970JSSCh...2..225P. doi:10.1016/0022-4596(70)90074-5. - ^ Bürgi, H. B. Motion and Disorder in Crystal Structure Analysis: Measuring and Distinguishing them. Annual Review of Physical Chemistry. 2000, 51: 275–296. Bibcode:2000ARPC...51..275B. PMID 11031283. doi:10.1146/annurev.physchem.51.1.275.
- ^ Müller, Peter. 5.067 Crystal Structure Refinement (PDF). Cambridge: MIT OpenCourseWare. 2009 [2013-10-13]. (
原始 内容 存 档 (PDF)于2020-08-06). - ^ 46.0 46.1 46.2 46.3 Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Vigoureux, P. The Gyromagnetic Ratio of the Proton. Contemporary Physics. 1961, 2 (5): 360–366. Bibcode:1961ConPh...2..360V. S2CID 5092147. doi:10.1080/00107516108205282.
- ^ Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy. Weinheim: Wiley-VCH: 752, 754. 2012. doi:10.1002/14356007.b05_471.
- ^ Cameron, A. G. W. Abundance of the Elements in the Solar System (PDF). Space Science Reviews. 1973, 15 (1): 121–146. Bibcode:1973SSRv...15..121C. S2CID 120201972. doi:10.1007/BF00172440. (
原始 内容 (PDF)存 档于2011-10-21). - ^ 50.0 50.1 50.2 Croswell, Ken. Fluorine: An element–ary Mystery. Sky and Telescope. September 2003 [2013-10-17]. (
原始 内容 存 档于2016-03-04). - ^ Clayton, Donald. Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. 2003: 101-104. ISBN 978-0-521-82381-4.
- ^ Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. On the origin of fluorine in the Milky Way. Monthly Notices of the Royal Astronomical Society. 2004, 354 (2): 575–580. Bibcode:2004MNRAS.354..575R. S2CID 12330666. arXiv:astro-ph/0410580
 . doi:10.1111/j.1365-2966.2004.08215.x.
. doi:10.1111/j.1365-2966.2004.08215.x.
- ^ 53.0 53.1 Jaccaud 2000,
第 384頁 . - ^ Schulze-Makuch, D.; Irwin, L. N. Life in the Universe: Expectations and Constraints 2nd. Berlin: Springer-Verlag. 2008: 121. ISBN 978-3-540-76816-6.
- ^ Haxel, G. B.; Hedrick, J. B.; Orris, G. J. Stauffer, P. H.; Hendley II, J. W. , 编. Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (报告). U.S. Geological Survey. 2005 [2014-01-31]. (
原始 内容 存 档于2020-07-19). - ^ 56.0 56.1 56.2 56.3 56.4 Greenwood & Earnshaw 1998,
第 795頁 . - ^ 57.0 57.1 Norwood, Charles J.; Fohs, F. Julius. Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey. 1907: 52.
- ^ 58.00 58.01 58.02 58.03 58.04 58.05 58.06 58.07 58.08 58.09 58.10 58.11 58.12 58.13 Villalba, Gara; Ayres, Robert U.; Schroder, Hans. Accounting for Fluorine: Production, Use, and Loss. Journal of Industrial Ecology. 2008, 11: 85–101. S2CID 153740615. doi:10.1162/jiec.2007.1075.
- ^ Kelly, T. D.; Miller, M. M. Historical Fluorspar Statistics. U.S. Geological Service. 2005 [2014-02-10]. (
原始 内容 存 档于2013-05-22). - ^ Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. The Need for Indigenous Fluorspar Production in England. British Geological Survey. 2008 [2013-10-13]. (
原始 内容 存 档于2016-08-07). - ^ 61.0 61.1 Gribble, G. W. Naturally Occurring Organofluorines. Neison, A. H. (编). Organofluorines. The Handbook of Environmental Chemistry 3N. Berlin: Springer. 2002: 121–136. ISBN 3-540-42064-9. doi:10.1007/10721878_5.
- ^ Richter, M.; Hahn, O.; Fuchs, R. Purple Fluorite: A Little Known Artists' Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe. Studies in Conservation. 2001, 46 (1): 3. JSTOR 1506878. S2CID 191611885. doi:10.1179/sic.2001.46.1.1.
- ^ 63.0 63.1 Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian. Occurrence of Difluorine F2 in Nature-In Situ Proof and Quantification by NMR Spectroscopy. Angewandte Chemie International Edition. 2012, 51 (31): 7847–7849. ISSN 1521-3773. PMID 22763992. doi:10.1002/anie.201203515.
- ^ Greenwood & Earnshaw 1998,
第 790頁 . - ^ Senning, A. Elsevier's Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. 2007: 149. ISBN 978-0-444-52239-9.
- ^ Stillman, John Maxson. Basil Valentine, A Seventeenth Century Hoax. Popular Science Monthly. December 1912, 81 [2013-10-14]. (
原始 内容 存 档于2023-07-22). - ^ Principe, Lawrence M. The Secrets of Alchemy. Chicago: University of Chicago Press. 2012: 140, 145. ISBN 978-0-226-68295-2.
- ^ Agricola, Hoover & Hoover 1912,footnotes and commentary, pp. xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Earnshaw 1998,
第 109頁 . - ^ Agricola, Hoover & Hoover 1912,preface, pp. 380–381.
- ^ 71.0 71.1 71.2 71.3 71.4 Weeks, M. E. The Discovery of the Elements. XVII. The Halogen Family. Journal of Chemical Education. 1932, 9 (11): 1915–1939. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- ^ Partington, J. R. The early history of hydrofluoric acid. Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 1923, 67 (6): 73–87.
- ^ Marggraf, Andreas Sigismun. Observation concernant une volatilisation remarquable d'une partie de l'espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d'hesperos; laquelle volatilisation a été effectuée au moyen des acides [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l'Académie royale des sciences et belles-lettres. 1770, XXIV: 3–11 (
法 语). - ^ 74.0 74.1 74.2 74.3 74.4 74.5 74.6 Kirsch 2004,
第 3–10頁 . - ^ Scheele, Carl Wilhelm. Undersŏkning om fluss-spat och dess syra [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science]. 1771, 32: 129–138 (
瑞 典 语). - ^ Ampère, André-Marie. Suite d'une classification naturelle pour les corps simples. Annales de chimie et de physique. 1816, 2: 1–5 (
法 语). - ^ Davy, Humphry. Some experiments and observations on the substances produced in different chemical processes on fluor spar. Philosophical Transactions of the Royal Society. 1813, 103: 278. doi:10.1098/rstl.1813.0034
 .
.
- ^ Banks, R. E. Isolation of fluorine by Moissan: Setting the scene. Journal of Fluorine Chemistry. 1986, 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- ^ 79.0 79.1 Storer, Frank H. First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis. 1864: 278–280.
- ^
劉 懷 樂 .化學 鑑 源 與 略 考 .化學 教育 . 1994, (04) [2013-02-25]. (原始 内容 存 档于2013-10-04). - ^ 81.0 81.1 81.2 81.3 81.4 Toon, Richard. The discovery of fluorine. Education in Chemistry. Vol. 48 no. 5 (Royal Society of Chemistry). 2011-09-01: 148–151 [2022-10-23]. ISSN 0013-1350. (
原始 内容 存 档于2019-03-29). - ^ 82.0 82.1 Asimov, Isaac. The Noble Gases. New York: Basic Books. 1966: 162. ISBN 978-0-465-05129-8.
- ^ Greenwood & Earnshaw 1998,
第 789–791頁 . - ^ Moissan, Henri. Action d'un courant électrique sur l'acide fluorhydrique anhydre. Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1886, 102: 1543–1544 [2013-10-09]. (
原始 内容 存 档于2020-08-06) (法 语). - ^ Viel, Claude; Goldwhite, Harold. 1906 Nobel Laureate: Henri Moissan, 1852–1907. Laylin, K. James (编). Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. 1993: 35. ISBN 978-0-8412-2690-6.
- ^ 86.0 86.1 86.2 Okazoe, T. Overview on the History of Organofluorine Chemistry from the Viewpoint of Material Industry. Proceedings of the Japan Academy, Series B. 2009, 85 (8): 276–289 [2022-10-23]. Bibcode:2009PJAB...85..276O. PMC 3621566
 . PMID 19838009. doi:10.2183/pjab.85.276. (
. PMID 19838009. doi:10.2183/pjab.85.276. (原始 内容 存 档于2020-08-06). - ^ 87.0 87.1 Hounshell, David A.; Smith, John Kelly. Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. 1988: 156–157. ISBN 0-521-32767-9.
- ^ DuPont. Freon. 2013a [2013-10-17]. (
原始 内容 存 档于2015-02-21). - ^ Meyer, Eugene. Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. 1977: 111. ISBN 978-0-13-129239-0.
- ^ Kirsch 2004,
第 60–66頁 . - ^ Riedel, Sebastian; Kaupp, Martin. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- ^ Wiberg, Wiberg & Holleman 2001,
第 422頁 . - ^ Schlöder, T.; Riedel, S. Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2O2]+, [F2Cl2]+, [Cl2O2]+, [F4]+, and [Cl4]+. RSC Advances (Royal Society of Chemistry). 2012, 2 (3): 876–881. Bibcode:2012RSCAd...2..876S. doi:10.1039/C1RA00804H.
- ^ Harbison, G. S. The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF. Journal of the American Chemical Society. 2002, 124 (3): 366–367. PMID 11792193. doi:10.1021/ja0159261.
- ^ Edwards, Philip Neil. Use of Fluorine in Chemotherapy. Banks, R. E.; Smart, B. E.; Tatlow, J. C. (编). Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. 1994: 515. ISBN 978-0-306-44610-8.
- ^ Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo. SIMS Experiment. Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (编). Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. 1999: 267. ISBN 4-06-208635-2.
- ^ 97.0 97.1 Aigueperse 2000,
第 420–422頁 . - ^ Walsh, Kenneth A. Beryllium Chemistry and Processing. Materials Park: ASM International. 2009. ISBN 978-0-87170-721-5.
- ^ Emeléus & Sharpe 1983,
第 89–97頁 . - ^ Babel, Dietrich; Tressaud, Alain. Crystal Chemistry of Fluorides. Hagenmuller, Paul (编). Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. 1985: 91–96. ISBN 978-0-12-412490-5.
- ^ Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. The Crystal Structure of Gold Trifluoride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, 4: 478–482. doi:10.1039/J19670000478.
- ^ Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam. Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. 2005: 144. ISBN 978-0-444-51803-3.
- ^ 103.0 103.1 Perry, Dale L. Handbook of Inorganic Compounds 2nd. Boca Raton: CRC Press. 2011: 193. ISBN 978-1-4398-1461-1.
- ^ Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. Temperature Variation of the Structural Parameters in Actinide Tetrafluorides. The Journal of Chemical Physics. 1994, 101 (11): 9333–9337 [2022-11-04]. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963. (
原始 内容 存 档于2021-04-14). - ^ Lide 2004,
第 4.60, 4.76, 4.92, 4.96頁 . - ^ Lide 2004,
第 4.96頁 . - ^ Lide 2004,
第 4.92頁 . - ^ Greenwood & Earnshaw 1998,
第 964頁 . - ^ Becker, S.; Müller, B. G. Vanadium Tetrafluoride. Angewandte Chemie International Edition in English. 1990, 29 (4): 406–407. doi:10.1002/anie.199004061.
- ^ Greenwood & Earnshaw 1998,
第 990頁 . - ^ Lide 2004,
第 4.72, 4.91, 4.93頁 . - ^ 112.0 112.1 Greenwood & Earnshaw 1998,
第 561–563頁 . - ^ Emeléus & Sharpe 1983,
第 256–277頁 . - ^ Mackay, Mackay & Henderson 2002,
第 355–356頁 . - ^ Greenwood & Earnshaw 1998,
看 对应金属 的 页面. - ^ Lide 2004,
第 4.71, 4.78, 4.92頁 . - ^ Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. Solid State Molecular Structures of Transition Metal Hexafluorides. Inorganic Chemistry. 2006, 45 (9): 3782–3788. PMID 16634614. doi:10.1021/ic052029f.
- ^ Greenwood & Earnshaw 1998,
第 819頁 . - ^ Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. The Crystal Structure of Gold Trifluoride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, 4: 478–482. doi:10.1039/J19670000478.
- ^ Pauling, Linus. The Nature of the Chemical Bond
 3rd. Ithaca: Cornell University Press. 1960: 454–464. ISBN 978-0-8014-0333-0.
3rd. Ithaca: Cornell University Press. 1960: 454–464. ISBN 978-0-8014-0333-0.
- ^ Atkins, Peter; Jones, Loretta. Chemical Principles: The Quest for Insight
 4th. New York: W. H. Freeman. 2007: 184–185. ISBN 978-1-4292-0965-6.
4th. New York: W. H. Freeman. 2007: 184–185. ISBN 978-1-4292-0965-6.
- ^ Emsley, John. The Hidden Strength of Hydrogen. New Scientist. 1981, 91 (1264): 291–292 [2024-01-18]. (
原始 内容 存 档于2023-07-22). - ^ Greenwood & Earnshaw 1998,
第 812–816頁 . - ^ Wiberg, Wiberg & Holleman 2001,
第 425頁 . - ^ Clark, Jim. The Acidity of the Hydrogen Halides. chemguide.co.uk. 2002 [2013-10-15]. (
原始 内容 存 档于2012-05-31). - ^ Chambers, C.; Holliday, A. K. Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. 1975: 328–329. ISBN 978-0-408-70663-6. (
原始 内容 (PDF)存 档于2013-03-23). - ^ Air Products and Chemicals. Safetygram #39 Chlorine Trifluoride (PDF). Air Products and Chemicals: 1. 2004 [2014-02-16]. (
原始 内容 (PDF)存 档于2006-03-18). - ^ Noury, S.; Silvi, B.; Gillespie, R. J. Chemical Bonding in Hypervalent Molecules: Is the Octet Rule Relevant? (PDF). Inorganic Chemistry. 2002, 41 (8): 2164–2172 [2012-05-23]. PMID 11952370. doi:10.1021/ic011003v. (
原始 内容 存 档于2020-05-11). - ^ Chang, Raymond; Goldsby, Kenneth A. Chemistry 11th. New York: McGraw-Hill. 2013: 706. ISBN 978-0-07-131787-0.
- ^ Ellis, Brian. Scientific Essentialism. Cambridge: Cambridge University Press. 2001: 69. ISBN 978-0-521-80094-5.
- ^ Aigueperse 2000,
第 423頁 . - ^ Wiberg, Wiberg & Holleman 2001,
第 897頁 . - ^ Raghavan, P. S. Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. 1998: 164–165. ISBN 978-81-7141-418-5.
- ^ Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. Inorganic Derivatives of the Elements. Norman, Nicholas C. (编). Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. 1998: 98. ISBN 978-0-7514-0389-3.
- ^ Aigueperse 2000,
第 432頁 . - ^ Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. University Chemistry I. New Delhi: New Age International. 1995: 180–182, 206–208. ISBN 978-81-224-0742-6.
- ^ Greenwood & Earnshaw 1998,
第 638–640, 683–689, 767–778頁 . - ^ Wiberg, Wiberg & Holleman 2001,
第 435–436頁 . - ^ Greenwood & Earnshaw 1998,
第 828–830頁 . - ^ Patnaik 2007,
第 478–479頁 . - ^ Moeller, T.; Bailar, J. C.; Kleinberg. Chemistry, with Inorganic Qualitative Analysis 3rd. New York: Academic Press. 1980: 236. ISBN 0-12-503350-8.
- ^ Wiberg, Wiberg & Holleman 2001,
第 392–393頁 . - ^ Wiberg, Wiberg & Holleman 2001,
第 395–397, 400頁 . - ^ Lewars 2008,
第 68頁 . - ^ Pitzer, Kenneth S. (编). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. 1993: 111. ISBN 978-981-02-1439-5.
- ^ Lewars 2008,
第 67頁 . - ^ 147.0 147.1 Bihary, Z.; Chaban, G. M.; Gerber, R. B. Stability of a Chemically Bound Helium Compound in High-pressure Solid Helium. The Journal of Chemical Physics. 2002, 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- ^ Lewars 2008,
第 71頁 . - ^ Hoogers, G. Fuel Cell Components and Their Impact on Performance. Hoogers, G. (编). Fuel Cell Technology Handbook. Boca Raton: CRC Press. 2002: 4-12. ISBN 0-8493-0877-1.
- ^ O'Hagan, D. Understanding Organofluorine Chemistry. An Introduction to the C–F Bond. Chemical Society Reviews. 2008, 37 (2): 308–319. PMID 18197347. doi:10.1039/b711844a.
- ^ Siegemund 2005,
第 444頁 . - ^ Sandford, Graham. Organofluorine Chemistry. Philosophical Transactions. 2000, 358 (1766): 455. Bibcode:2000RSPTA.358..455S. S2CID 202574641. doi:10.1098/rsta.2000.0541.
- ^ Siegemund 2005,
第 451–452頁 . - ^ Barbee, K.; McCormack, K.; Vartanian, V. EHS Concerns with Ozonated Water Spray Processing. Mendicino, L. (编). Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. 2000: 116. ISBN 978-1-56677-230-3.
- ^ Posner, Stefan; et al. Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology (PDF). Copenhagen: Nordic Council of Ministers. 2013: 187–190 [2024-01-18]. ISBN 978-92-893-2562-2. doi:10.6027/TN2013-542. (
原始 内容 存 档 (PDF)于2023-07-09). - ^ 156.0 156.1 Posner, Stefan. Perfluorinated Compounds: Occurrence and Uses in Products. Knepper, Thomas P.; Large, Frank T. (编). Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. 2011: 27. ISBN 978-3-642-21871-2.
- ^ Salager, Jean-Louis. Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. 2002: 45 [2013-10-13]. (
原始 内容 (PDF)存 档于2020-07-31). - ^ 158.0 158.1 Carlson & Schmiegel 2000,
第 3頁 . - ^ Carlson & Schmiegel 2000,
第 3–4頁 . - ^ Rhoades, David Walter. Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor. 2008: 2. ISBN 978-0-549-78540-8.
- ^ Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. Ion and Water Transport Characteristics of Nafion Membranes as Electrolytes. Electrochimica Acta. 1998, 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- ^ Carlson & Schmiegel 2000,
第 4頁 . - ^ Jaccaud 2000,
第 386頁 . - ^ Jaccaud 2000,
第 384–385頁 . - ^ 165.0 165.1 Jaccaud 2000,
第 390–391頁 . - ^ Shriver, Duward; Atkins, Peter. Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. 2010: 427. ISBN 978-1-4292-5255-3.
- ^ Christe, Karl O. Chemical Synthesis of Elemental Fluorine. Inorganic Chemistry. 1986, 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- ^ Christe Research Group. Chemical Synthesis of Elemental Fluorine. n.d. [2013-01-12]. (
原始 内容 存 档于2016-03-04). - ^ Carey, Charles W. African Americans in Science. Santa Barbara: ABC-CLIO. 2008: 173. ISBN 978-1-85109-998-6.
- ^ Miller, M. Michael. Mineral Resource of the Month, Fluorspar (PDF). U.S. Geological Survey. 2003 [2013-10-24]. (
原始 内容 存 档 (PDF)于2017-02-17). - ^ PRWeb. Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc.. prweb.com. 2012-02-23 [2013-10-24]. (
原始 内容 存 档于2020-07-31). - ^ Bombourg, Nicolas. World Fluorochemicals Market, Freedonia. Reporterlinker. 2012-07-04 [2013-10-20]. (
原始 内容 存 档于2020-04-23). - ^ Transparency Market Research. Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research. Transparency Market Research Blog. 2013-05-17 [2013-10-15]. (
原始 内容 存 档于2014-02-22). - ^ Fulton, Robert B.; Miller, M. Michael. Fluorspar. Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (编). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). 2006: 471. ISBN 978-0-87335-233-8.
- ^ 175.0 175.1 Jaccaud 2000,
第 392頁 . - ^ Aigueperse 2000,
第 430頁 . - ^ Jaccaud 2000,
第 391–392頁 . - ^ El-Kareh, Badih. Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. 1994: 317. ISBN 978-0-7923-9534-8.
- ^ Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. Isotropic Etching of Silicon in Fluorine Gas for MEMS Micromachining. Journal of Micromechanics and Microengineering. 2007, 17 (2): 384–392. Bibcode:2007JMiMi..17..384A. S2CID 135708022. doi:10.1088/0960-1317/17/2/026.
- ^ Miller, M. Michael. Fluorspar (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. 2003: 27.1–27.12 [2023-11-19]. (
原始 内容 存 档 (PDF)于2004-11-01). - ^ Energetics, Inc. Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (报告): 41, 50. 1997 [2013-10-15].
- ^ Aigueperse 2000,
第 428頁 . - ^ Willey, Ronald R. Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. 2007: 113. ISBN 978-0-615-14397-2.
- ^ PRWeb. Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc.. prweb.com. 2010-10-28 [2013-10-24]. (
原始 内容 存 档于2020-07-31). - ^ 185.0 185.1 185.2 Renner, R. The Long and the Short of Perfluorinated Replacements. Environmental Science & Technology. 2006, 40 (1): 12–13. Bibcode:2006EnST...40...12R. PMID 16433328. doi:10.1021/es062612a
 .
.
- ^ Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. Perfluorocarbon Fluids. Banks, R. E.; Smart, B. E.; Tatlow, J. C. (编). Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. 1994: 91–93. ISBN 978-0-306-44610-8.
- ^ DuPont. Understanding the Refrigerant 'R' Nomenclature. 2013b [2013-10-17]. (
原始 内容 存 档于2014-10-03). - ^ 188.0 188.1 Walter, P. Honeywell Invests $300m in Green Refrigerant. Chemistry World. 2013 [2024-01-18]. (
原始 内容 存 档于2016-03-04). - ^ 189.0 189.1 Buznik, V. M. Fluoropolymer Chemistry in Russia: Current Situation and Prospects. Russian Journal of General Chemistry. 2009, 79 (3): 520–526. S2CID 97518401. doi:10.1134/S1070363209030335.
- ^ PRWeb. Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets. prweb.com. 2013-04-07 [2013-10-24]. (
原始 内容 存 档于2020-07-31). - ^ 191.0 191.1 191.2 191.3 191.4 Martin, John W. (编). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. 2007: 187–194. ISBN 978-0-08-045127-5.
- ^ DeBergalis, Michael. Fluoropolymer films in the photovoltaic industry. Journal of Fluorine Chemistry. 2004, 125 (8): 1255–1257. doi:10.1016/j.jfluchem.2004.05.013.
- ^ Grot, Walter. Fluorinated Ionomers 2nd. Oxford and Waltham: Elsevier. 2011: 1–10. ISBN 978-1-4377-4457-6.
- ^ Ramkumar, Jayshree. Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications. Banerjee, S.; Tyagi, A. K. (编). Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. 2012: 567. ISBN 978-0-12-385142-0.
- ^ Burney, H. Past, Present and Future of the Chlor-Alkali Industry. Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. (编). Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. 1999: 111. ISBN 1-56677-244-3.
- ^ Slye, Orville M. Fire Extinguishing Agents. Ullmann, Franz (编). Ullmann's Encyclopedia of Industrial Chemistry 15. Weinheim: Wiley-VCH. 2012: 10. ISBN 978-3527306732. doi:10.1002/14356007.a11_113.pub2.
- ^ Kissa, Erik. Fluorinated Surfactants and Repellents 2nd. New York: Marcel Dekker. 2001: 516–551. ISBN 978-0-8247-0472-8.
- ^ Ullmann, Fritz. Ullmann's Fibers (2 volumes). Weinheim: Wiley-VCH. 2008: 538, 543–547. ISBN 978-3-527-31772-1.
- ^ ICIS. Fluorine's Treasure Trove. Reed Business Information. 2006-10-02 [2013-10-24]. (
原始 内容 存 档于2009-02-26). - ^ 200.0 200.1 Theodoridis, George. Fluorine-Containing Agrochemicals: An Overview of Recent Developments. Tressaud, Alain (编). Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. 2006: 121–176. ISBN 978-0-444-52672-4.
- ^ United States Environmental Protection Agency. R.E.D. Facts: Trifluralin (PDF). 1996 [2013-10-17]. (
原始 内容 (PDF)存 档于2013-10-18). - ^ Directorate-General for the Environment (European Commission). Trifluralin (PDF) (报告). European Commission. 2007 [2013-10-14]. (
原始 内容 存 档于2020-07-28). - ^ Beasley, Michael. Guidelines for the safe use of sodium fluoroacetate (1080) (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). August 2002 [2013-11-11]. ISBN 0-477-03664-3. (
原始 内容 (PDF)存 档于2013-11-11). - ^ 204.0 204.1 Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. Sodium Fluoroacetate Poisoning. Toxicological Reviews. 2006, 25 (4): 213–219. PMID 17288493. S2CID 29189551. doi:10.2165/00139709-200625040-00002.
- ^ Eisler, Ronald. Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (报告). Patuxent Environmental Science Center (U.S. National Biological Service). 1995 [2011-06-05]. (
原始 内容 存 档 (PDF)于2020-03-07). - ^ Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. Community Water Fluoridation and Caries Prevention: A Critical Review (PDF). Clinical Oral Investigations. 2007, 11 (3): 189–193 [2023-02-23]. PMID 17333303. S2CID 13189520. doi:10.1007/s00784-007-0111-6. (
原始 内容 存 档 (PDF)于2020-07-24). - ^ Centers for Disease Control and Prevention. Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States. MMWR Recommendations and Reports. 2001, 50 (RR–14): 1–42 [2013-10-14]. PMID 11521913. (
原始 内容 存 档于2007-02-08). - ^ Ripa, L. W. A Half-century of Community Water Fluoridation in the United States: Review and Commentary (PDF). Journal of Public Health Dentistry. 1993, 53 (1): 17–44. PMID 8474047. doi:10.1111/j.1752-7325.1993.tb02666.x. (
原始 内容 (PDF)存 档于2009-03-04). - ^ 209.0 209.1 Cheng, K. K.; Chalmers, I.; Sheldon, T. A. Adding Fluoride to Water Supplies (PDF). BMJ. 2007, 335 (7622): 699–702 [2012-03-26]. PMC 2001050
 . PMID 17916854. doi:10.1136/bmj.39318.562951.BE. (
. PMID 17916854. doi:10.1136/bmj.39318.562951.BE. (原始 内容 (PDF)存 档于2016-03-03). - ^ National Health and Medical Research Council. A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results (PDF). Canberra: Australian Government. 2007 [2013-10-08]. ISBN 978-1-86496-421-9. (
原始 内容 (PDF)存 档于2012-01-13). - ^ Yeung, C. A. A Systematic Review of the Efficacy and Safety of Fluoridation. Evidence-Based Dentistry. 2008, 9 (2): 39–43. PMID 18584000. doi:10.1038/sj.ebd.6400578
 .
.
- ^ Marya, C. M. A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. 2011: 343. ISBN 978-93-5025-216-1.
- ^ Armfield, J. M. When Public Action Undermines Public Health: A Critical Examination of Antifluoridationist Literature. Australia and New Zealand Health Policy. 2007, 4: 25 [2023-02-28]. PMC 2222595
 . PMID 18067684. doi:10.1186/1743-8462-4-25. (
. PMID 18067684. doi:10.1186/1743-8462-4-25. (原始 内容 存 档于2016-01-27). - ^ 214.0 214.1 Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian. Caries Control for Populations. Fejerskov, Ole; Kidd, Edwina (编). Dental Caries: The Disease and Its Clinical Management 2nd. Oxford: Blackwell Munksgaard. 2008: 518. ISBN 978-1-4051-3889-5.
- ^ Cracher, Connie M. Current Concepts in Preventive Dentistry (PDF). dentalcare.com: 12. 2012 [2013-10-14]. (
原始 内容 (PDF)存 档于2013-10-14). - ^ Emsley 2011,
第 178頁 . - ^ Johnson, Linda A. Against Odds, Lipitor Became World's Top Seller. The Boston Globe. 2011-12-28 [2013-10-24].
- ^ 218.0 218.1 Swinson, Joel. Fluorine – A Vital Element in the Medicine Chest (PDF). PharmaChem (Pharmaceutical Chemistry). June 2005: 26–27 [2013-10-09]. (
原始 内容 (PDF)存 档于2012-02-08). - ^ Hagmann, W. K. The Many Roles for Fluorine in Medicinal Chemistry. Journal of Medicinal Chemistry. 2008, 51 (15): 4359–4369. PMID 18570365. doi:10.1021/jm800219f.
- ^ Mitchell, E. Siobhan. Antidepressants
 . New York: Chelsea House Publishers. 2004: 37–39. ISBN 978-1-4381-0192-7.
. New York: Chelsea House Publishers. 2004: 37–39. ISBN 978-1-4381-0192-7.
- ^ Preskorn, Sheldon H. Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. 1996. ISBN 978-1-884735-08-0.
- ^ Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. Unnecessary use of Fluoroquinolone Antibiotics in Hospitalized Patients. BMC Infectious Diseases. 2011, 11: 187–193. PMC 3145580
 . PMID 21729289. doi:10.1186/1471-2334-11-187.
. PMID 21729289. doi:10.1186/1471-2334-11-187.
- ^ Brody, Jane E. Popular Antibiotics May Carry Serious Side Effects. The New York Times Well Blog. 2012-09-10 [2013-10-18].
- ^ Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. Food Safety: Fluoroquinolone‐ResistantCampylobacterSpecies and the Withdrawal of Fluoroquinolones from Use in Poultry: A Public Health Success Story (PDF). Clinical Infectious Diseases. 2007, 44 (7): 977–980 [2023-12-08]. PMID 17342653. doi:10.1086/512369
 . (
. (原始 内容 存 档 (PDF)于2022-09-01). - ^ King, D. E.; Malone, R.; Lilley, S. H. New Classification and Update on the Quinolone Antibiotics. American Family Physician. 2000, 61 (9): 2741–2748 [2013-10-08]. PMID 10821154.
- ^ Parente, Luca. The Development of Synthetic Glucocorticoids. Goulding, Nicolas J.; Flower, Rod J. (编). Glucocorticoids. Basel: Birkhäuser. 2001: 40. ISBN 978-3-7643-6059-7.
- ^ Raj, P. Prithvi; Erdine, Serdar. Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. 2012: 58. ISBN 978-0-470-67038-5.
- ^ Filler, R.; Saha, R. Fluorine in Medicinal Chemistry: A Century of Progress and a 60-year Retrospective of Selected Highlights (PDF). Future Medicinal Chemistry. 2009, 1 (5): 777–791. PMID 21426080. doi:10.4155/fmc.09.65. (
原始 内容 (PDF)存 档于2013-10-22). - ^ Bégué, Jean-Pierre; Bonnet-Delpon, Danièle. Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. 2008: 335–336. ISBN 978-0-470-27830-7..
- ^ 230.0 230.1 Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. Use of Fluorine-18 Fluoro-2-deoxy-D-glucose Positron Emission Tomography in Assessing the Process of Tuberculous Spondylitis (PDF). Journal of Spinal Disorders. 2000, 13 (6): 541–544 [2013-10-08]. PMID 11132989. doi:10.1097/00002517-200012000-00016. (
原始 内容 存 档 (PDF)于2020-05-08). - ^ Bustamante, E.; Pedersen, P. L. High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase. Proceedings of the National Academy of Sciences. 1977, 74 (9): 3735–3739. Bibcode:1977PNAS...74.3735B. PMC 431708
 . PMID 198801. doi:10.1073/pnas.74.9.3735
. PMID 198801. doi:10.1073/pnas.74.9.3735  .
.
- ^ Alavi, Abbas; Huang, Steve S. Positron Emission Tomography in Medicine: An Overview. Hayat, M. A. (编). Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. 2007: 41. ISBN 978-0-12-370468-9.
- ^ Gabriel, J. L.; Miller, T. F. Jr.; Wolfson, M. R.; Shaffer, T. H. Quantitative Structure-Activity Relationships of Perfluorinated Hetero-Hydrocarbons as Potential Respiratory Media. ASAIO Journal. 1996, 42 (6): 968–973. PMID 8959271. S2CID 31161098. doi:10.1097/00002480-199642060-00009.
- ^ Sarkar, S. Artificial Blood. Indian Journal of Critical Care Medicine. 2008, 12 (3): 140–144. PMC 2738310
 . PMID 19742251. doi:10.4103/0972-5229.43685.
. PMID 19742251. doi:10.4103/0972-5229.43685.
- ^ Schimmeyer, S. The Search for a Blood Substitute. Illumin (Columbia: University of Southern Carolina). 2002, 15 (1) [2013-10-15]. (
原始 内容 存 档于2011-10-02). - ^ Davis, Nicole. Better than blood. Popular Science. November 2006 [2013-10-20]. (
原始 内容 存 档于2011-06-04). - ^ Gains, Paul. A New Threat in Blood Doping. The New York Times. 1998-10-18 [2013-10-18]. (
原始 内容 存 档于2023-04-07). - ^ Taber, Andrew. Dying to ride. Salon. 1999-04-22 [2013-10-18]. (
原始 内容 存 档于2018-11-06). - ^ Shaffer, T. H.; Wolfson, M. R.; Clark, L. C. Jr. Liquid Ventilation. Pediatric Pulmonology. 1992, 14 (2): 102. PMID 1437347. S2CID 222167378. doi:10.1002/ppul.1950140208.
- ^ Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. American Journal of Respiratory and Critical Care Medicine. 2006, 173 (8): 882–9. PMID 16254269. doi:10.1164/rccm.200508-1196OC.
- ^ Nielsen, Forrest H. Micronutrients in Parenteral Nutrition: Boron, Silicon, and Fluoride. Gastroenterology. 2009, 137 (5): S55–60 [2018-04-29]. PMID 19874950. doi:10.1053/j.gastro.2009.07.072
 . (
. (原始 内容 存 档于2020-07-30). - ^ Olivares, M.; Uauy, R. Essential Nutrients in Drinking Water (Draft) (PDF) (报告). World Health Organization (WHO). 2004 [2013-10-14]. (
原始 内容 (PDF)存 档于2012-10-19). - ^ 243.0 243.1 Murphy, C. D.; Schaffrath, C.; O'Hagan, D. Fluorinated Natural Products: The Biosynthesis of Fluoroacetate and 4-Fluorothreonine in Streptomyces cattleya. Chemosphere. 2003, 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. PMID 12738270. doi:10.1016/S0045-6535(03)00191-7.
- ^ O'Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. Biochemistry: Biosynthesis of an Organofluorine Molecule. Nature. 2002, 416 (6878): 279. Bibcode:2002Natur.416..279O. PMID 11907567. S2CID 4415511. doi:10.1038/416279a
 .
.
- ^ National Oceanic and Atmospheric Administration.
- ^ The National Institute for Occupational Safety and Health. Fluorine. Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). 1994 [2014-01-15]. (
原始 内容 存 档于2022-12-08). - ^ The National Institute for Occupational Safety and Health. Chlorine. Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). 1994 [2014-07-13]. (
原始 内容 存 档于2023-02-05). - ^ 248.0 248.1 Keplinger, M. L.; Suissa, L. W. Toxicity of Fluorine Short-Term Inhalation. American Industrial Hygiene Association Journal. 1968, 29 (1): 10–18. PMID 5667185. doi:10.1080/00028896809342975.
- ^ CDC - NIOSH Pocket Guide to Chemical Hazards -Fluorine. www.cdc.gov. [2015-11-03]. (
原始 内容 存 档于2015-11-17). - ^ Emsley 2011,
第 179頁 . - ^ Biller, José. Interface of Neurology and Internal Medicine illustrated. Philadelphia: Lippincott Williams & Wilkins. 2007: 939 [2023-02-19]. ISBN 978-0-7817-7906-7. (
原始 内容 存 档于2023-07-22). - ^ Eaton, Charles. Figure hfl. E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). 1997 [2013-09-28].
- ^ Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S (PDF). American Journal of Industrial Medicine. 2001, 40 (2): 215–220. PMID 11494350. doi:10.1002/ajim.1090. (
原始 内容 (PDF)存 档于2012-07-17). - ^ Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis. Goldfrank's Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. 2007: 1333. ISBN 978-0-07-144310-4.
- ^ 255.0 255.1 Honeywell. Recommended medical treatment for hydrofluoric acid exposure (PDF). Morristown: Honeywell International. 2006 [2014-01-09]. (
原始 内容 (PDF)存 档于2013-10-08). - ^ Fischman, Michael L. Semiconductor Manufacturing Hazards. Sullivan, John B.; Krieger, Gary R. (编). Clinical Environmental Health and Toxic Exposures 2nd. Philadelphia: Lippincott Williams & Wilkins. 2001: 458–459. ISBN 978-0-683-08027-8.
- ^ El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. Hydrofluoric Acid Dermal Exposure. Veterinary and Human Toxicology. 1989, 31 (3): 243–247. PMID 2741315.
- ^ Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. Topical Treatment of Experimental Hydrofluoric Acid Skin Burns by 2.5% Calcium Gluconate. Journal of Burn Care & Research. 2006, 27 (6): 889–894. PMID 17091088. S2CID 3691306. doi:10.1097/01.BCR.0000245767.54278.09.
- ^ Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. Hexafluorine vs. Standard Decontamination to Reduce Systemic Toxicity After Dermal Exposure to Hydrofluoric Acid. Clinical Toxicology. 2004, 42 (4): 355–361. PMID 15461243. S2CID 27090208. doi:10.1081/CLT-120039541.
- ^ Zorich, Robert. Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. 1991: 182-183. ISBN 978-0-323-14055-3.
- ^ Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. Environmental Health Criteria 227 (Fluoride). Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. 2002: 100 [2013-10-14]. ISBN 92-4-157227-2. (
原始 内容 存 档于2020-01-12). - ^ 262.0 262.1 262.2 Shin, Richard D.; Silverberg, Mark A. Fluoride Toxicity. Medscape. 2013 [2013-10-15]. (
原始 内容 存 档于2020-08-06). - ^ Reddy, D. Neurology of Endemic Skeletal Fluorosis. Neurology India. 2009, 57 (1): 7–12 [2023-02-23]. PMID 19305069. doi:10.4103/0028-3886.48793. (
原始 内容 存 档于2021-11-05). - ^ Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community. Revista Panamericana de Salud Pública. 2000, 7 (4): 242–248. PMID 10846927. doi:10.1590/S1020-49892000000400005
 .
.
- ^ 265.0 265.1 Augenstein, W. L.; et al. Fluoride Ingestion in Children: A Review of 87 cases. Pediatrics. 1991, 88 (5): 907–912 [2023-02-19]. PMID 1945630. S2CID 22106466. doi:10.1542/peds.88.5.907. (
原始 内容 存 档于2010-10-02). - ^ Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. Acute Fluoride Poisoning from a Public Water System. New England Journal of Medicine. 1994, 330 (2): 95–99. PMID 8259189. doi:10.1056/NEJM199401133300203
 .
.
- ^ Centers for Disease for Control and Prevention. Community Water Fluoridation. 2013-07-10 [2013-10-25]. (
原始 内容 存 档于2017-07-05). - ^ Shulman, J. D.; Wells, L. M. Acute Fluoride Toxicity from Ingesting Home-use Dental Products in Children, Birth to 6 Years of Age. Journal of Public Health Dentistry. 1997, 57 (3): 150–158. PMID 9383753. doi:10.1111/j.1752-7325.1997.tb02966.x.
- ^ Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori. What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?. National Aeronautics and Space Administration. 2011 [2013-10-15].
- ^ Aucamp, Pieter J.; Björn, Lars Olof. Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update (PDF). United Nations Environmental Programme. 2010 [2013-10-14]. (
原始 内容 (PDF)存 档于2013-09-03). - ^ Mitchell Crow, James. First signs of ozone-hole recovery spotted. Nature. 2011. doi:10.1038/news.2011.293.
- ^ Barry, Patrick L.; Phillips, Tony. Good News and a Puzzle. National Aeronautics and Space Administration. 2006-05-26 [2012-01-06]. (
原始 内容 存 档于2010-05-27). - ^ United States Environmental Protection Agency. Class I Ozone-depleting Substances. 2013a [2013-10-15]. (
原始 内容 存 档于2010-12-10). - ^ 274.0 274.1 United States Environmental Protection Agency. Phaseout of HCFCs (Class II Ozone-Depleting Substances). 2013b [2013-10-15]. (
原始 内容 存 档于2015-09-24). - ^ McCoy, M. SURVEY Market Challenges Dim the Confidence of the World's Chemical CEOs. Chemical & Engineering News. 2007, 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- ^ Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhr e, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. Changes in Atmospheric Constituents and in Radiative Forcing. Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. (编). Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. 2007: 212–213. ISBN 978-0-521-70596-7.
- ^ Schwarcz, Joseph A. The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life
 . Toronto: ECW Press. 2004. ISBN 1-55022-621-5.
. Toronto: ECW Press. 2004. ISBN 1-55022-621-5.
- ^ Giesy, J. P.; Kannan, K. Perfluorochemical Surfactants in the Environment. Environmental Science & Technology. 2002, 36 (7): 146A–152A. Bibcode:2002EnST...36..146G. PMID 11999053. doi:10.1021/es022253t
 .
.
- ^ 279.0 279.1 279.2 279.3 Steenland, K.; Fletcher, T.; Savitz, D. A. Epidemiologic Evidence on the Health Effects of Perfluorooctanoic Acid (PFOA). Environmental Health Perspectives. 2010, 118 (8): 1100–1108. PMC 2920088
 . PMID 20423814. doi:10.1289/ehp.0901827.
. PMID 20423814. doi:10.1289/ehp.0901827.
- ^ 280.0 280.1 280.2 280.3 Betts, K. S. Perfluoroalkyl Acids: What is the Evidence Telling Us?. Environmental Health Perspectives. 2007, 115 (5): A250–A256. PMC 1867999
 . PMID 17520044. doi:10.1289/ehp.115-a250.
. PMID 17520044. doi:10.1289/ehp.115-a250.
- ^ United States Environmental Protection Agency. Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA) (PDF). 2012 [2013-11-04]. (
原始 内容 (PDF)存 档于2013-10-29). - ^ Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients. Chemosphere. 2013, 91 (6): 725–32. Bibcode:2013Chmsp..91..725Z. PMID 23498059. doi:10.1016/j.chemosphere.2013.02.024.
- ^ 283.0 283.1 Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings. Toxicological Sciences. 2007, 99 (2): 366–394. PMID 17519394. doi:10.1093/toxsci/kfm128
 .
.
参考 书目[编辑]
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry. De Re Metallica. London: The Mining Magazine. 1912.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. Fluorine Compounds, Inorganic. Weinheim: Wiley-VCH: 397–441. 2000. ISBN 3527306730. doi:10.1002/14356007.
- Carlson, D. P.; Schmiegel, W., Fluoropolymers, Organic: 495–533, 2000, ISBN 3527306730, doi:10.1002/14356007.a11_393
- Dean, John A. Lange's Handbook of Chemistry 15th. New York: McGraw-Hill. 1999. ISBN 0-07-016190-9.
- Emeléus, H. J.; Sharpe, A. G. Advances in Inorganic Chemistry and Radiochemistry 27. Academic Press. 1983. ISBN 0-12-023627-3.
- Emsley, John. Nature's Building Blocks: An A–Z Guide to the Elements 2nd. Oxford: Oxford University Press. 2011. ISBN 978-0-19-960563-7.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford: Butterworth Heinemann. 1998. ISBN 0-7506-3365-4.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. Fluorine. Weinheim: Wiley-VCH: 381–395. 2000. ISBN 3527306730. doi:10.1002/14356007.a11_293.
- Kirsch, Peer. Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. 2004. ISBN 978-3-527-30691-6.
- Lewars, Errol G. Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. 2008 [2023-11-19]. ISBN 978-1-4020-6972-7. (
原始 内容 存 档于2023-07-22). - Lide, David R. Handbook of Chemistry and Physics
 84th. Boca Raton: CRC Press. 2004. ISBN 0-8493-0566-7.
84th. Boca Raton: CRC Press. 2004. ISBN 0-8493-0566-7. - Lidin, R.; Molochko, V. A.; Andreeva, L. L. Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances]. Moscow: Khimiya. 2000. ISBN 5-7245-1163-0 (
俄 语). - Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. Introduction to Modern Inorganic Chemistry 6th. Cheltenham: Nelson Thornes. 2002. ISBN 0-7487-6420-8.
- Patnaik, Pradyot. A Comprehensive Guide to the Hazardous Properties of Chemical Substances 3rd. Hoboken: John Wiley & Sons. 2007. ISBN 978-0-471-71458-3.
- Siegemund, Günter; Schwertfeger, Werner; Feiring, Andrew; Smart, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blaine, Fluorine Compounds, Organic, Wiley, 2000-06-15, ISBN 978-3-527-30385-4, doi:10.1002/14356007.a11_349
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick. Inorganic Chemistry. San Diego: Academic Press. 2001. ISBN 978-0-12-352651-9.
外部 連結 [编辑]
元素 氟在洛 斯阿拉 莫斯国家 实验室 的 介 紹(英文 )- EnvironmentalChemistry.com —— 氟(
英文 ) 元素 氟在 The Periodic Table of Videos(諾 丁 漢 大學 )的 介 紹(英文 )元素 氟在Peter van der Krogt elements site的 介 紹(英文 )- WebElements.com – 氟(
英文 )
| | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||




























