Karbeenit

Karbeenit ovat orgaanisia yhdisteitä, jotka ovat ulkoisesti varauksettomia ja joillain niiden hiiliatomilla on kuusi elektronia uloimmalla elektronikuorellaan. Näistä elektroneista neljä osallistuu sidoksien muodostamiseen ja kaksi ovat vapaana.[1][2][3]
Rakenne
[muokkaa | muokkaa wikitekstiä]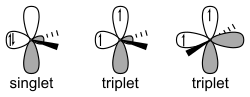
Karbeenit voidaan jakaa kahteen ryhmään vapaiden elektronien perusteella. Karbeenissa kuusi valenssielektronia sisältävä hiiliatomi on sp2-hybridisoitunut. Vapaat elektronit voivat olla pariutuneena vapaaksi elektronipariksi, jolloin niillä on vastakkaistakkaiset spinit. Tällaisia karbeeneja kutsutaan singlettikarbeeneiksi. Singlettiakrbeeneilla vapaa elektronipari sijaitsee hajottavalla sp2-orbitaalilla ja singlettikarbeenilla on tällöin yksi tyhjä p-orbitaali. Elektronien spinit voivat olla myös samansuuntaiset, jolloin kyseessä on triplettikarbeeni.[1][2] Triplettitilan energia on hieman singlettitilan energiaa alempi.[3][4][5]
Rakenteeltaan karbeenit ovat tyypillisesti taipuneita, mutta osa niistä on lineaarisia. Singlettikarbeeneissa sp2-hybridisoituneen hiilen sidoskulma on tyypillisesti 100–110° ja triplettikarbeeneissa se on useimmiten 130–150°. Karbeeneja tunnetaan niin suoraketjuisia, rengasrakenteisia kuin heterokarbeenejakin, jotka sisältävät typpeä tai piitä.[3][4][5]
Karbeenien valmistus
[muokkaa | muokkaa wikitekstiä]Karbeeneja voidaan valmistaa usealla tavalla. Tyypillisiä ovat alkyylihalogenidien
Alkyylihalogenidien α -eliminaatio
[muokkaa | muokkaa wikitekstiä]Alkyylihalogenideista, jotka eivät sisällä vetyä
Karbeenien valmistus diatsokarbonyyliyhdisteistä ja p-tosyylihydratsoneista
[muokkaa | muokkaa wikitekstiä]Kuumennettaessa tai säteilytettäessä diatsokarbonyyliyhdisteitä ne hajoavat vapauttaen typpeä ja karbeenin. Karbeenit muodostumista voidaan nopeuttaa käyttämällä katalyyttinä rodiumin tai eräiden muiden siirtymämetallien yhdisteitä.[3][4][5]
p-Tosyylihydratsonit reagoivat vahvojen emästen kanssa eliminaatioreaktiolla, joka muodostaa diatsoyhdisteen välituotteena. Tämä diatsoyhdiste hajoaa edelleen lämmitettäessä typeksi ja karbeeniksi.[3][4][5]
Karbeenien reaktioita
[muokkaa | muokkaa wikitekstiä]Karbeenit ovat hyvin reaktiivisia yhdisteitä ja voivat muodostuttuaan toisiintua tai fragmentoitua muiksi yhdisteiksi. Karbeenit esiintyvätkin pääasiassa vain reaktiivisina välituotteina muun muassa additioreaktioissa ja insertioreaktioissa.[3][4][5]
Additioreaktiot
[muokkaa | muokkaa wikitekstiä]
Tyypillisimpiä karbeenien reaktioita ovat additioreaktiot kaksoissidoksiin muodostaen syklopropaanijohdannaisia ja tämä on yksi käytetyimpiä tapoja syklopropaanijohdannaisten valmistukseen. Reaktion tyyppi riippuu reagoivasta karbeenista. Singlettikarbeeneilla reaktio on sykloadditio, kuten taas triplettikarbeenit muodostavat ensin radikaalin.[3][5]
Insertioreaktiot
[muokkaa | muokkaa wikitekstiä]
Additioreaktioiden lisäksi karbeeneille ovat tyypillisiä insertioreaktiot. Ne kykenevät reagoimaan alkoholien kanssa muodostaen eettereitä ja hiilivetyjen kanssa muodostaen pidentyneen hiilivetyketjun. Näin voidaan valmistaa sekä syklisiä että avoketjuisia hiilivetyjä, joiden hiilivetyketju on pidentynyt.[3][5]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b Carbenes goldbook.iupac.org. Viitattu 8.4.2014. (englanniksi)
- ↑ a b Leila Kotama ja Antti Kivinen: Suomalaisten Kemistien Seuran sanastotoimikunnan julkaisuja nro 5: Fysikaalisen orgaanisen kemian sanasto. Suomen Kemian Seura, 1983. ISBN 951-9223-20-7 (englanniksi)
- ↑ a b c d e f g h i j Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry, s. 1005–1020. Oxford University Press, 2012. ISBN 978-0-19-927029-3 (englanniksi)
- ↑ a b c d e f Michael B. Smith & Jerry March: March's Advanced Organic Chemistry, s. 283–292. John Wiley & Sons, 2007. ISBN 978-0-471-72091-1 (englanniksi)
- ↑ a b c d e f g h Francis A. Carey & Richard J. Sundberg: Organic Chemistry B: Reactions and synthesis, s. 903–916. Springer, 2007. ISBN 978-0-387-68350-8 (englanniksi)
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä] Kuvia tai muita tiedostoja aiheesta Karbeenit Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Karbeenit Wikimedia Commonsissa


