Décaline
| Décaline | |

| |
| Identification | |
|---|---|
| Nom UICPA | décahydronaphtalène |
| Synonymes |
décaline |
| No CAS | |
| No ECHA | 100.001.861 |
| No CE | 202-046-9 |
| PubChem | 7044 |
| ChEBI | 38853 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H18 [Isomères] |
| Masse molaire[1] | 138,249 9 ± 0,009 3 g/mol C 86,88 %, H 13,12 %, |
| Propriétés physiques | |
| T° fusion | −40 °C [2] |
| T° ébullition | 189 à 191 °C [2] |
| Paramètre de solubilité |
18,0 MPa1/2 (25 °C)[3] |
| Masse volumique | 0,88 g·cm-3 à 20 °C [2] |
| T° d'auto-inflammation | 255 °C [2] |
| Point d’éclair | 57 °C [2] |
| Limites d’explosivité dans l’air | 0,7–4,9 %vol [2] |
| Pression de vapeur saturante | 1,3 mbar à 20 °C [2] |
| Viscosité dynamique | 3 mPa·s à 20 °C [2] |
| Précautions | |
| SGH[2] | |
| H226, H314, H332, H411, P273, P280, P301+P330+P331, P305+P351+P338 et P309+P310 |
|
| SIMDUT[4] | |
  B3, D2B, |
|
| NFPA 704[5] | |
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 4,17 g·kg-1 (rat, oral) [6] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La décaline (décahydronaphtalène) aussi connue sous le nom de bicyclo[4.4.0]décane[7] est un hydrocarbure bicyclique non-aromatique. C'est un liquide incolore avec une odeur aromatique utilisé comme solvant industriel pour de nombreuses résines ou pour des additifs de carburant[8]. Comme son nom l'indique, c'est l'analogue saturé du naphtalène et peut être préparé par hydrogénation de ce dernier en état de fusion en présence d'un catalyseur. Le décahydronaphtalène forme facilement des hydroperoxydes explosifs[9] lorsqu'il est stocké en présence d'air[10],[11].
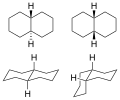
Isomères
[modifier | modifier le code]Le décahydronaphtalène existe sous la forme d'isomère cis et trans. L'isomère trans est énergétiquement plus stable car il présente moins d'interactions stériques. La cis-décaline est une molécule qui pourrait être chirale sans centre de chiralité : elle possède deux axes de symétrie par rotation passant par le centre de la liaison 1-6 mais pas d'axe de symétrie. Cependant, cette chiralité s'annule par une retournement de type chaise qui transforme la molécule en son image dans un miroir.
-
1: Isomères trans (gauche) et cis (droite)
-
2: cis-décaline
-
3: trans-décaline
Trans-décaline
[modifier | modifier le code]-
4: Demi-molécule de décaline = cyclohexane en conformation chaise. Les atomes en position axiale sont indiqués en rouge, ceux en position équatoriale en bleu.
-
5: Androstanédiol, un stérol possédant trois cycles à 6 trans fusionnés (ainsi qu'un cycle à 5 trans fusionné)
Comme on peut le voir sur le modèle du cyclohexane, la configuration trans impose le fait que lorsque deux anneaux sont fusionnés en position trans, le second doit débuter sur deux atomes en position équatoriale du premier cycle.
Cette configuration impose aussi une rigidité des anneaux dans une conformation fixe. En biologie cette fixation est très répandue dans le squelette des stéroïdes.
Voir aussi
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Decahydronaphthalene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 mars 2011 (JavaScript nécessaire)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- « Décahydronaphtalène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 1 mars 2011
- « UCB »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) Université du Colorado
- (en) « Décaline », sur ChemIDplus, consulté le 1 mars 2011
- (en) « Dictionary.com »
- (en) « Fuel Additive Product »
- (en) « PDF – Surrogate JP-8 Aviation Fuel Study – Alessandro Agosta Thesis Drexel University »
- (en) « Inchem.org Data »
- (en) « MSDS Sheet – JT Baker »
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Decalin » (voir la liste des auteurs).