Krebsov ciklus
Krebsov ciklus, ciklus limunske kiseline ili ciklus trikarboksilnih kiselina (TCA ciklus) jedan je od temeljnih metaboličkih ciklusa kod stanica koje se koriste kisikom tijekom staničnog disanja. Kod aerobnih je organizama Krebsov ciklus ključni metabolički proces koji spaja puteve degradacije (katabolizma) ugljikohidrata, lipida (masti) i bjelančevina u ugljični dioksid i vodu uz oslobađanje kemijske energije.
Krebsov je ciklus amfibolički metabolički put s obzirom na to da sudjeluje i u degradaciji organskih molekula (katabolizam) i u biosintezi molekula (anabolizam). Najvažniji su metabolički putovi koji se vežu na Krebsov ciklus glikoliza i oksidativna dekarboksilacija piruvata koje mu prethode i oksidativna fosforilacija koja ga slijedi. Krebsov ciklus važan je i kao izvor prekursora aminokiselina (acetil CoA,
Krebsov se ciklus odvija u mitohondrijima eukariotskih stanica i u citoplazmi prokariotskih stanica. Katabolizam ugljikohidrata i masti stvara acetil-CoA, molekulu sastavljenu od jedne acetilne skupine vezane na koenzim A. Acetil-CoA je osnovni supstrat Krebsovog ciklusa. Dvije molekule acetil-CoA oslobađaju svoje acetilne skupine, koje se spajaju s oksalacetatom i formiraju limunsku kiselinu. Limunska kiselina prolazi kroz niz metaboličkih procesa, oslobađa dvije molekule ugljičnog dioksida (CO2) i regenerira se ponovo u oksalacetat koji je spreman za sljedeći ciklus. Najbitnije reakcije u energetskom smislu su formiranje molekule GTP, koja odmah regenerira jednu molekulu ATP, proizvodnja tri molekule NADH i jedne FADH2.[1] Za ključne kemijske reakcije i enzime koje se odvijaju u Krebsovom ciklusu, kao i za njihove produkte vidi tablicu niže.[2]
Reducirani kofaktori (NADH i FADH2) imaju ulogu prijelaznih molekula u procesima oksidacije i redukcije. U reduciranom stanju prenose elektrone od oksidiranih molekula iz samog Krebsovog ciklusa i glikolize do prve faze oksidativne fosforilacije, tzv. lanca prijenosa elektrona. Tada dolazi do oksidacije u NAD+ i FAD i davanja elektrona, koji će za vrijeme oksidativne fosforilacije bili iskorišteni za regeneriranje ATP iz ADP.[3]
Konačna stehiometrijska formula svih reakcija je sljedeća:
Energija koja se dobije od potpune razgradnje jedne molekule glukoze kroz tri faze staničnog disanja (glikoliza, Krebsov ciklus i oksidativna fosforilacija) je 36 molekula ATP. U stvarnosti se proizvede 38 molekula ATP, ali dvije su iskorištene za prijenos (aktivnim transportom) dviju molekula NADH proizvedenih putem glikolize iz citoplazme kroz membranu mitohondrija.

| Supstrat | Koenzim | Enzim | Vrsta reakcije | Inibitori | Aktivatori | Produkt | |
|---|---|---|---|---|---|---|---|
| 1 | oksalacetat | acetil-CoA, voda | citrat sintetaza | kondenzacija | citrat, NADH, sukcinil-CoA | - | citrat |
| 2a | citrat | - | akonitaza | dehidracija | - | - | cis-akonitat, voda |
| 2b | cis-akonitat | voda | hidracija | isocitrat | |||
| 3a | izocitrat | NAD+ | izocitrat dehidrogenaza | oksidacija | NADH, ATP | Ca2+, ADP | oksalsukcinat, NADH |
| 3b | oksalsukcinat | H+ | dekarboksilacija | ||||
| 4 | NAD+, CoA-SH | oksidativna dekarboksilacija | NADH, sukcinil-CoA | Ca2+ | sukcinil-CoA, NADH, CO2 | ||
| 5 | sukcinil-CoA | GDP, fosfat | sukcinil-CoA sintetaza | fosforilacija | - | - | sukcinat, GTP, CoA-SH |
| 6 | sukcinat | FAD | sukcinat deihdrogenaza | oksidacija | - | - | fumarat, FADH2 |
| 7 | fumarat | voda | fumaraza | hidracija | - | - | L-malat |
| 8 | L-malat | NAD+ | malat deidrogenaza | oksidacija | - | - | oksalacetat, NADH |


Prvi enzim u Krebsovom ciklusu, citrat sintetaza katalizira reakciju kondenzacije acetil-CoA s oksalacetatom iz kojeg nastaje citrat (limunska kiselina). Enzim ima dvije strukturne podjedinice i svaka od njih sposobna je vezati oba supstrata za svoje aktivno mjesto. Enzim katalizira aktivaciju acetil-CoA, kako bi povećao afinitet prema oksalacetatu. Nakon povezivanja acetilne skupine na oksalacetat, tioesterna se grupa (CoA) odvaja hidrolizom kako bi se oslobodila limunska kiselina.
Jednadžba reakcije: Acetil-CoA + oksakacetat + H2O → citrat + CоА + H+
Reakcija je vrlo egzoergonska tj. oslobađa energiju (


Akonitaza katalizira izomerizaciju limunske kiseline (citrata) u izocitrat kroz prijelazno formiranje cis-akonitata. Citrat prolazi proces dehidracije C3 ugljika i stvaranje međuspoja cis-akonitata, koji se potom hidrira u C2 formirajući izocitrat. Reakcija može teći i u suprotnom smjeru, ali to se ne događa u Krebsovom ciklusu zbog zakona o djelovanju masa. Koncentracija citrata je 91%, međuspoja cis-akonitata je 3%, a izocitrata 6%. Reakcija stoga nepovratno teče prema izocitratu.
Jednadžba reakcije: citrat → cis-akonitat + H2O → izocitrat U aktivnom mjestu akonitaze nalazi se skupina željezo-sumpor koja veže supstrat, zajedno s određenim polarnim aminokiselinama. Prostorna struktura aktivnog mjesta dopušta samo vezivanje 1R,2S citrata, odbijajući suprotni izomer.[5]

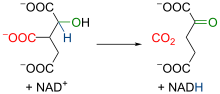
Mitohondrijska izocitrat dehidrogenaza je enzim koji je ovisan o NAD+, Mn2+ i/ili Mg2+. U početku enzim katalizira oksidaciju izocitrata u oksalsukcinat i proizvede jednu molekulu NADH od NAD+. Potom jedan bivalentni ion (Mn2+ ili Mg2+) veže kisik iz karboksilne skupine i povećava elektronegativnost tog dijela molekule. Dolazi do preraspodjele elektrona u molekuli, kidanja kemijske veze i oslobađanja karboksilne skupine. Dekarboksilacijom dolazi do formiranja
Jednadžba reakcije: izocitrat + NAD+ → Oksalsukcinat + NADH + H+; Oksalsukcinat →


Pretvorba
Jednadžba reakcije:

Sukcinil CoA je tioester visoke kemijske energije (njegova
Energija prisutna u tioesteru se jednostavno pretvori u energiju u obliku fosfatnih veza koje se kasnije koriste kao univerzalni izvor energije u gotovo svim endoergonskim metaboličkim procesima u cijelom organizmu. U prvom koraku reakcije enzim eliminira Koenzim A iz sukcinil CoA i nastaje međuspoj visoke energije sukcinil fosfat. Potom dolazi do primanja fosfata od jedne molekule histidina prisutom u aktivnom mjestu enzima koji oslobađa sukcinat kao konačni proizvod reakcije i formiranja fosfohistidina. Fosfohistidin odmah prebacuje fosfat na GDP pretvarajući ga u GTP. To je jedina reakcija u Krebsovom ciklusu kod koje dolazi do fosforilacije na nivou substrata.[8]
Jednadžba reakcije: sukcinat-CоА + Pi + GDP → sukcinat + GTP + CоА-SH Organizam ne koristi direktno GTP kao molekulu visoke energije (GTP ima ulogu signalne molekule). Njegova je uloga u Krebsovom ciklusu da posluži kao međuspoj koji prebacuje fosfatnu grupu na ADP kako bi se stvorio ATP. Tu reakciju katalizira enzim nukleozid difosfokinaza.
U završnim fazama Krebsovog ciklusa dolazi do preraspodjele molekula s četiri atoma ugljika do ponovne regeneracije oksalacetata. Da bi to bilo moguće, metilna grupa prisutna na sukcinatu mora doživjeti konverziju u karbonilnu grupu. Konverzija nastaje u tri prijelaza: prva oksidacija, pa hidracija, potom druga oksidacija. Navedeni prijelazi, osim što regeneriraju oksalacetat, omogućavaju „izvlačenje“ dodatne kemijske energije putem nastanka flavin adenin FADH2 i NADH.

.

Prvu reakciju oksidacije katalizira enzimski kompleks sukcinat dehidrogenaze, jedini enzim iz ciklusa koji ima FAD kao primatelja vodika umjesto NAD+. FAD je kovalentno vezan za enzim, preko jedne molekule histidina. Enzim koristi FAD kao primatelj vodika, pošto reakcija ne razvija dovoljno slobodne energije da reducira NAD+. Enzim katalizira oksidaciju sukcinata u fumarat.[9]
Jednadžba reakcije: sukcinat+ FAD → fumarat + FADH2
Enzimski sustav sukcinat dehidrogenaze je jedini iz cijelog ciklusa koji se nalazi unutar mitohondrijske membrane. Enzim se nalazi u toj poziciji pošto ulazi i u metabolički put lanca prijenosa elektrona (u kojem nosi naziv kompleks II). Nakon prijelaza na FAD, enzim ubacuje elektrone direktno u lanac prijenosa elektrona, koji je prvi dio oksidativne fosforilacije. To je moguće upravo zbog stabilne veze između enzima i samog kofaktora FAD.


Enzim fumaraza dodaje fumaratu jedan proton i jednu hidroksilnu grupu (OH-) dobivenu hidrolizom vode i formira malat kao konačni produkt. Enzim može vezati grupu OH- samo s jedne strane, tako da fumarat prelazi samo u L-malat.[11]
Jednadžba reakcije: fumarat + H2O → malat


Posljednja reakcija Krebsovog ciklusa predviđa oksidaciju malata u oksalacetat. Time se oksalacetat regenerira i ulazi u novi ciklus. Enzim malat dehidrogenaza koji katalizira reakciju koristi još jednu molekulu NAD+ kao primatelja vodika kako bi proizveo NADH.[13]
Jednadžba reakcije: malat + NAD+ → oksalacetat + NADH + H+
Aktivnost enzima je u potpunosti određena potrošnjom oksalacetata od strane citrat sintetaze (prvog enzima u Krebsovom ciklusu) i potrošnjom NADH od strane lanca prijenosa elektrona. Kontinuirano smanjenje koncentracije navedenih spojeva tjera enzim na stalnu proizvodnju novih spojeva.
Brzina kemijskih reakcija u Krebsovom ciklusu podložna je preciznioj regulaciji, razmjerno energetskim potrebama same stanice. Ključne točke kontrole su alosterični enzimi, izocitrat dehidrogenaza i
Isocitrat dehidrogenazu stimulira prisutnost ADP, koji se veže za enzim, i povećava afinitet prema substratu. Simultano vezanje substrata (isocitrata), NAD+, Mg2+ i ADP na enzim ima potencirajući utjecaj na aktivaciju, dok NADH i ATP smanjuju aktivnost enzima, jer zauzimaju aktivno mjesto vezivanja aktivacijskih spojeva (kompetitivna inhibicija).
Sljedeća ključna točka kontrole je regulacija aktivnosti
Postoje dokazi o reguliranju aktivnosti Krebsovog ciklusa i prije samog ciklusa, na nivou opskrbe prvog enzima u procesu (citrat sintetaze). Velika koncentracija ATP smanjuje afinitet enzima prema svom osnovnom substratu acetil-CoA, smanjujući tako proizvodnju citrata. Stoga, što je više ATP u stanici, manja količina acetil-CoA ulazi u sam Krebsov ciklus.[14]

Krebsov ciklus ima središnju ulogu u metabolizmu živih bića, prije svega u katabolizmu organskih molekula, ali i u anabolizmu. Na Krebsov se ciklus nadovezuju različiti metabolički putevi koji između ostalog imaju ulogu opskrbe samog ciklusa međuspojevima koji su utrošeni kod biosinteze drugih organskih molekula. Te se kemijske reakcije zovu anaplerotičke reakcije.
Krebsov ciklus je drugi stupanj razgradnje ugljikohidrata. Prvi stupanj, glikoliza, razgrađuje glukozu (i ostale šećere) u pirogrožđanu kiselinu (piruvat),
Bjelančevine mogu indirektno poslužiti kao izvor energije i njihovi produkti ući u Krebsov ciklus. Bjelančevine se proteolizom razgrađuju u osnovne građevne jedinice: aminokiseline. Neke aminokiseline kao aspartat, valin i isoleucin mogu biti direktno pretvoreni u međuspojeve samog ciklusa.[17] Ostale mogu biti pretvorene u glucide (ugljikohidrate) i ući u ciklus preko metaboličkih puteva karakterističnih za ugljikohidrate.[18]
Produkti razgradnje masti su također izuzetno važan izvor energije koji direktno i indirektno ulaze u Krebsov ciklus. Masti su razgrađene od enzima lipaze koje oslobađaju masne kiseline i glicerol. Glicerol može ući u proces glikolize, pogotovo u stanicama jetre ili biti pretvoren u glukozu putem glukoneogeneze. U mnogim tkivima, pogotovo srcu, masne se kiseline razgrađuju kroz proces beta oksidacije koja direktno proizvodi acetil CoA, osnovni supstrat Krebsovog ciklusa. Beta oksidacija može proizvesti i propionil CoA, koji će putem glukoneogeneze biti pretvoren u glukozu.[19]
Osnovni proces koji slijedi Krebsov ciklus je oksidativna fosforilacija, metabolički put gdje završava stanično disanje. Glavna uloga oksidativne fosforilacije je oksidacija kofaktora NADH i FADH2, koji ponovo ulaze u Krebsov ciklus u oksidiranom obliku NAD+ i FAD. Ovaj proces osidacije generira gradijent protona i elektrona, čija se energija iskoristi za proces fosforilacije molekula ADP u visokoenergetske molekule ATP. U tom se procesu protoni (H+) vežu na kisik, kojeg organizmi unose iz atmosfere i stvaraju vodu kao konačni produkt. Oksidativna fosforilacija uvelike povećava efikasnost proizvodnje visokoenergetskih nukleozida kao ATP i GTP koja je relativno niska kod Krebsovog ciklusa.[20]
Međuspojevi Krebsovog ciklusa ulaze u mnoge druge metaboličke puteve. U popisu niže, navedeni su metaboliti Krebsovog ciklusa i metabolički putevi u kojima sudjeluju.
- Acetil CoA:
- beta oksidacija
- biosinteza masnih kiselina;
- degradacija lizina
- degradacija valina i izoleucina
- metabolizam fenilalanina
α -ketoglutarat:- biosinteza lizina
- metabolizam askorbinske kiseline
- metabolizam glutamata
- Sukcinil CoA:
- metabolizam propanoata
- biosinteza porfirina
- degradacija leucina i izoleucina
- metabolizam fenilalanina
- Sukcinat:
- metabolizam butanoata
- metabolizam tirozina
- Fumarat:
- ciklus uree
- metabolizam arginina i prolina
- metabolizam tirozina
- Oksalacetat:
- glukoneogeneza
- metabolizam glutamata i aspartata
- metabolizam glikoksilne kiseline
- ↑ Johnson, JD; Mehus, JG; Tews, K; Milavetz, BI; Lambeth, DO. 1998. Genetic evidence for the expression of ATP- and GTP-specific succinyl-CoA synthetases in multicellular eucaryotes. J Biol Chem. 273 (42): 27580.–6. doi:10.1074/jbc.273.42.27580. ISSN 0021-9258. PMID 9765291
- ↑ Barnes, SJ; Weitzman, PD. Lipanj 1986. Organization of citric acid cycle enzymes into a multienzyme cluster. FEBS Lett. 201 (2): 267.–70. doi:10.1016/0014-5793(86)80621-4. PMID 3086126
- ↑ Berg, J. M.; Tymoczko, J. L.; Stryer, L. 2002. Biochemistry 5th izdanje. WH Freeman and Company. str. 465.–484., 498.–501. ISBN 0-7167-4684-0
- ↑ C. Usher, J. Remington, P. Martin, G. Drueckhammer, A very short hydrogen bond provides only moderate stabilization of an enzyme-inhibitor complex of citrate synthase. In: Biochemistry 33, S. 7753.-7759., 1994.
- ↑ H. Lauble, C. D. Stout: Steric and conformational features of the aconitase mechanism. In: Proteins 22, S. 1.-11., 1995
- ↑ Mesecar, A.D., Stoddard, B.L., Koshland Jr., D.E. Orbital steering in the catalytic power of enzymes: small structural changes with large catalytic consequences. Science v 277 202.-206., 1997.
- ↑ Knapp, J.E., Carroll, D., Lawson, J.E., Ernst, S.R., Reed, L.J., Hackert, M.L. Expression, purification, and structural analysis of the trimeric form of the catalytic domain of the Escherichia coli dihydrolipoamide succinyltransferase. Protein Sci. v 9. 37.-48., 2000.
- ↑ Fraser, M.E., James, M.N., Bridger, W.A., Wolodko, W.T. Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase. J.Mol.Biol. v 299 1325.-1339., 2000.
- ↑ V. Yankovskaya, R. Horsefield, S. Tornroth, C. Luna-Chavez, H. Miyoshi, C. Leger, B. Byrne, G. Cecchini, S. Iwata: Architecture of succinate dehydrogenase and reactive oxygen species generation. In: Science 299, S. 700.-704., 2003.
- ↑ Weaver, T., Lees, M., Zaitsev, V., Zaitseva, I., Duke, E., Lindley, P., McSweeny, S., Svensson, A., Keruchenko, J., Keruchenko, I., Gladilin, K., Banaszak, L. Crystal structures of native and recombinant yeast fumarase. J.Mol.Biol. v 280 431.-442., 1998.
- ↑ Adrian D. Hegeman; Frey, Perry A. 2007. Enzymatic reaction mechanisms. Oxford University Press. Oxford [Oxfordshire]. ISBN 0-19-512258-5CS1 održavanje: više imena: authors list (link)
- ↑ Tomita, T., Fushinobu, S., Kuzuyama, T., Nishiyama, M. Structural basis for alteration of cofactor specificity of malate dehydrogenase from Thermus flavus
- ↑ Goward CR, Nicholls DJ. Listopad 1994. Malate dehydrogenase: a model for structure, evolution, and catalysis. Protein Sci. 3 (10): 1883.–8. doi:10.1002/pro.5560031027. PMC 2142602. PMID 7849603
- ↑ Voet, D.; Voet, J. G. 2004. Biochemistry 3rd izdanje. John Wiley & Sons, Inc.. New York. str. 615
- ↑ Romano AH, Conway T. (1996.) Evolution of carbohydrate metabolic pathways. Res Microbiol. 147(6-7):448.-55. PMID 9084754
- ↑ Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS. Lipanj 2003. Structural basis for flip-flop action of thiamin pyrophosphate-dependent enzymes revealed by human pyruvate dehydrogenase. J. Biol. Chem. 278 (23): 21240.–6. doi:10.1074/jbc.M300339200. PMID 12651851CS1 održavanje: više imena: authors list (link)
- ↑ Sakami W, Harrington H. 1963. Amino acid metabolism. Annual Review of Biochemistry. 32 (1): 355.–98. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484
- ↑ Young VR, Ajami AM. Rujan 2001. Glutamine: the emperor or his clothes?. The Journal of Nutrition. 131 (9 Suppl): 2449S.–59S., discussion 2486S–7S. PMID 11533293
- ↑ Halarnkar, P; Blomquist, G. 1989. Comparative aspects of propionate metabolism. Comp. Biochem. Physiol., B. 92 (2): 227.–31. doi:10.1016/0305-0491(89)90270-8. PMID 2647392
- ↑ Mitchell P, Moyle J. 1967. Chemiosmotic hypothesis of oxidative phosphorylation. Nature. 213 (5072): 137.–9. doi:10.1038/213137a0. PMID 4291593
- (engl.)Citric acid cycle Animation Arhivirana inačica izvorne stranice od 1. svibnja 2009. (Wayback Machine)(flash required)
- (engl.)An animation of the citric acid cycle at Smith College
- (engl.)Notes on citric acid cycle Arhivirana inačica izvorne stranice od 22. svibnja 2008. (Wayback Machine) at rahulgladwin.com
- (engl.)Citric acid cycle variants at MetaCyc
- (engl.)Pathways connected to the citric acid cycle Arhivirana inačica izvorne stranice od 26. listopada 2008. (Wayback Machine) at KEGG|Kyoto Encyclopedia of Genes and Genomes
- (engl.)A more detailed tutorial animation Arhivirana inačica izvorne stranice od 25. lipnja 2005. (Wayback Machine) at johnkyrk.com
- (engl.)A citric-acid cycle self quiz flash applet Arhivirana inačica izvorne stranice od 6. srpnja 2008. (Wayback Machine) at University of Pittsburgh
- (engl.)The chemical logic behind the citric acid cycle Arhivirana inačica izvorne stranice od 22. svibnja 2011. (Wayback Machine)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

