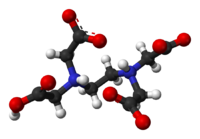
Etilén-diamin-tetraecetsav
| Etilén-diamin-tetraecetsav | |||

| |||
| |||
| IUPAC-név | N,N′-(etán-1,2-diil)bisz[N-(karboximetil)glicin][1] | ||
| Más nevek | H4EDTA diaminoetán-tetraecetsav etilén-dinitrilo-tetraecetsav VerseneTM | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 60-00-4 | ||
| ATC kód | V03AB03 | ||
| Gyógyszer szabadnév | edetates | ||
| Gyógyszerkönyvi név | Acidum edeticum | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C10H16N2O8 | ||
| Moláris tömeg | 292,25 g/mol | ||
| Sűrűség | 0,86 g/cm³ | ||
| Olvadáspont | 237–245 °C | ||
| Oldhatóság (vízben) | 0,5 g/l (25 °C) | ||
| Savasság (pKa) | pK1=0,0 (CO2H) (µ=1,0) pK2=1,5 (CO2H) (µ=0,1) pK3=2,00 (CO2H) (µ=0,1) pK4=2,69 (CO2H) (µ=0,1) pK5=6,13 (NH+) (µ=0,1) pK6=10,37 (NH+) (µ=0,1)[2] | ||
| Veszélyek | |||
| EU osztályozás | Irritatív (Xi)[3] | ||
| NFPA 704 | |||
| R mondatok | R36 [3] | ||
| S mondatok | (S2), S26[3] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az etilén-diamin-tetraecetsav (EDTA)[4] színtelen, vízben rosszul oldódó, erős kelátképző tulajdonságú, négyértékű poliamino-karbonsav.
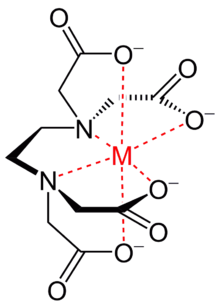
Ez a vegyület képes két- és háromértékű fémionokkal kelátkomplexet alkotni: a fémionokat a négy karboxilát- és két aminocsoportjával oktaéderes formájában köti meg. Különösen erős komplexet képez Mn(II), Cu(II), Fe(III), és Co(III) ionokkal.[5]
Előállítása[6]
Egyik ipari előállítása hidrogén-cianidból, formaldehidből és etiléndiaminból történik Strecker-szintézissel. A keletkező tetranitrilt lúgos közegben hidrolizálják, a keletkező nátriumsót sósavval elbontják.
- H2NCH2CH2NH2 + 4 CH2O + 4 HCN → (NCCH2)2NCH2CH2N(CH2CN)2 + 4 H2O
Egy másik, egylépéses gyártás nátrium-cianidból, formaldehidből és etiléndiaminból indul ki, majd a keletkező nátriumsót szintén sósavval bontják el.
- H2NCH2CH2NH2 + 4 CH2O + 4 NaCN + 4 H2O → (NaO2CCH2)2NCH2CH2N(CH2CO2Na)2 + 4 NH3
Iparilag főként a második eljárás használatos, az első módszerrel nagyon tiszta termék állítható elő. A sav mellett a következő sóit is jelentős mennyiségben állítják elő és forgalmazzák: dinátrium-etiléndiamin-tetraacetát (Na2H2EDTA, E386), tetranátrium-etíléndiamin-tetraacetát (Na4EDTA), kalcium-dinátrium-etiléndiamin-tetraacetát (CaNa2EDTA, E385).
Kimutatása és mennyiségi meghatározása
Biológiai mintákból történő kimutatásának és meghatározásának legérzékenyebb módszere a kiválasztott ionfolyamat követéses kapilláris elektroforézis–tömegspektrometria (rövidítve SRM–CE/MS), melynek emberi vérplazmából a kimutatási határa 7,3 ng/ml, meghatározási határa pedig 15 ng/ml.[7] Ehhez a módszerhez akár már ~7-8 nl mintamennyiség is elegendő.[7]
Alkoholt nem tartalmazó üdítőitalokban már 2,0
Felhasználása
Ipar
Ipari felhasználásai elsősorban a kelátképző tulajdonságán alapulnak, vizes oldatokban fémsók megkötésére használják.
- Textiliparban fémsó-szennyezések megkötésével színstabilitást fokoz valamint fehérítő fürdők stabilizátora.
Egészségügy
- Véranalízisben antikoagulációs hatása miatt alkalmazzák.
- Na2Ca-EDTA komplexet akut ólommérgezés esetén (vér 45 µg/dl fölötti ólomszintje) használják intravénás injekció révén (6 óránként 25 mg/ttkg 5 napig). A Pb2+-ionok a Ca2+-ionokkal kicserélődnek az ólom-EDTA nagyobb stabilitása révén. Az 5 napos kezelési időszakot nem célszerű túllépni, ugyanis 5 nap után a Zn2+-ionok is elkezdik kicserélni a Ca2+-ionokat, ami halálhoz vezethet.[forrás?]
Molekuláris biológiai kutatások
Felhasználják DNS-t bontó DNázok (dezoxiribonukleázok) gátlására DNS analízis során. A DNázok többsége aktivitáshoz Mg2+ iont igényel, amely az EDTA-val kelátot képez, így hozzáférhetetlenné válik számukra.
Veszélyei
Toxicitás
Akut toxicitása alacsony, LD50 értéke patkánynál 2,0–2,2 g/kg.[10] Laboratóriumi állatoknál citotoxicitást és gyenge genotoxikus hatást mutattak ki. Orálisan reprodukciós és fejlődési rendellenességeket okoz.[11] Ugyanez a tanulmány megállapította, hogy kozmetikumok topikális alkalmazása esetén, illetve aeroszol formájában belélegezve olyan alacsony kitettségi szintet okoz, hogy az az orális adagolásnál mért mérgező szint alá esik.
Környezetszennyezés
Széles körű és nagymennyiségű használata miatt mára perzisztens szerves szennyezőanyaggá vált.[12] Ennek oka a lebomlásában keresendő. Első lépésben etiléndiamin-triecetsavvá bomlik, amely következő lépésben diketopiperazin-származékká ciklizálódik. Ez a tényleges szennyezést okozó vegyület.
Lásd még
Kalcium-dinátrium-(etilén-diamin)-tetraacetát
Fordítás
Ez a szócikk részben vagy egészben az Ethylenediaminetetraacetic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Jegyzetek
- ↑ A cikkbeli eredeti név az IUPAC jelentésében szerepelt, de utóbb kiderült, hogy hibás Archiválva 2019. augusztus 1-i dátummal a Wayback Machine-ben.
- ↑ Harris, D.C. "Quantitative Chemical Analysis", 7th ed., W. H. Freeman and Compagny, New York, 2007
- ↑ a b c Etilén-diamin-tetraecetsav (ESIS)[halott link]
- ↑ 3.3 Komplexometria. In Burger Kálmán: Az analitikai kémia alapjai: Kémiai és műszeres elemzés. 5. Budapest: Semmelweis. 1999. 98. o. ISBN 9639214051
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Synthesis of EDTA
- ↑ a b Robin L. Sheppard, and Jack Henion (1997). „Determining EDTA in Blood” (angol nyelven) (– Scholar search). Analytical Chemistry 69 (15), 477A–480A. o. DOI:10.1021/ac971726p. PMID 9253241. (Hozzáférés: 2007. július 25.)
- ↑ S. Loyaux-Lawniczak, J. Douch, and P. Behra (1999). „Optimisation of the analytical detection of EDTA by HPLC in natural waters” (angol nyelven). Fresenius' J. Anal. Chem. 364 (8), 727–731. o. [2007. október 12-i dátummal az eredetiből archiválva]. DOI:10.1007/s002160051422. (Hozzáférés: 2007. július 25.)
- ↑ Carolina E. Cagnassoa, Laura B. López, Viviana G. Rodríguez and Mirta E. Valencia (2006. May). „Development and validation of a method for the determination of EDTA in non-alcoholic drinks by HPLC” (angol nyelven). Journal of Food Composition and Analysis 20 (3-4), 248. o. DOI:10.1016/j.jfca.2006.05.008. (Hozzáférés: 2007. július 25.)
- ↑ J. Roger Hart "Ethylenediaminetetraacetic Acid and Related Chelating Agents" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_095
- ↑ Lanigan RS and Yamarik TA (2002). „Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA”. Int J Toxicol. 21 Suppl 2, 95–142. o. DOI:10.1080/10915810290096522. PMID 12396676. (Hozzáférés: 2008. január 28.)
- ↑ Zhiwen Yuan, Jeanne M. VanBriesen "The Formation of Intermediates in EDTA and NTA Biodegradation" Environmental Engineering Science 2006, volume 23, pp. 533-544. doi:10.1089/ees.2006.23.533

