Ghiaccio

Ghiaccio è il nome comune usato per designare l'acqua allo stato solido. È un solido cristallino trasparente: a pressione atmosferica standard (101 325 Pa) la transizione di fase avviene quando l'acqua liquida viene raffreddata sotto lo 0 °C (273,15 K, 32 °F).
Descrizione
[modifica | modifica wikitesto]
Solidificazione
[modifica | modifica wikitesto]L'acqua può rimanere allo stato liquido anche sotto 0 °C a causa del fenomeno di sopraffusione (fino a -42 °C) oppure con pressioni superiori a quella normale (fino a -30 °C); viceversa il ghiaccio può formarsi anche a temperature superiori a 0 °C con pressioni inferiori a quella normale. Esistono quindici differenti fasi solide dell'acqua, ma la più comune è la Ih, che è l'unica presente nella biosfera, a parte una piccola percentuale di Ic rintracciabile nell'alta atmosfera. Le varie fasi del ghiaccio formate a pressioni differenti da quella normale hanno una struttura cristallina differente da quella del ghiaccio comune.
Ghiaccio, acqua e vapore acqueo possono coesistere al punto triplo, che per questo sistema è posto alla temperatura di 273,16 K (0,01 °C) e alla pressione di 611,73 Pa.
Peculiarità
[modifica | modifica wikitesto]Una caratteristica insolita del ghiaccio è che il solido ha una densità che è circa dell'8% inferiore a quella dell'acqua liquida. A 0 °C e a pressione atmosferica, il ghiaccio ha una densità di 0,9168 g/cm³, l'acqua di 0,9998 g/cm³. L'acqua liquida raggiunge il massimo di densità, esattamente 1 g/cm³, a 4 °C e a partire da questo valore diventa meno densa mentre la temperatura scende verso gli 0 °C quando le sue molecole iniziano a disporsi nelle geometrie esagonali che daranno luogo alla formazione del ghiaccio. Ciò è dovuto ai legami che si formano tra le molecole d'acqua per mezzo degli atomi di idrogeno, che allineano le molecole in maniera meno efficiente, in termini di volume, quando l'acqua congela.

Una delle conseguenze è che il ghiaccio galleggia sull'acqua, un fattore importante per il clima della Terra e essenziale per la vita acquatica (e per la vita in generale) perché, bloccando i fenomeni di convezione, impedisce che l'acqua sottostante continui a raffreddarsi e congeli tutta.
Scivolosità
[modifica | modifica wikitesto]Un corpo che si muove sul ghiaccio si sposta "scivolando", cioè senza diminuire in maniera consistente la propria velocità. Ciò è dovuto al fatto che un corpo poggiato sul ghiaccio è soggetto alla forza peso che lo spinge verso il basso; tale forza si manifesta come una pressione che agisce sulla superficie di contatto tra il corpo in questione e il ghiaccio sottostante, e provoca una parziale fusione del ghiaccio, con la formazione di un sottile strato di acqua che aderisce al corpo e ne permette lo scivolamento.
Grazie alla formazione del suddetto sottile strato d'acqua, le due superfici solide (il corpo che scivola e la superficie ghiacciata) non sono direttamente a contatto, per cui il movimento viene rallentato dall'attrito viscoso (che si esplica tra l'acqua e le superfici solide), che è nettamente inferiore all'attrito radente che si avrebbe se le superfici solide fossero direttamente a contatto.

Inoltre, la pressione è data dal rapporto tra la forza applicata e l'area della superficie di contatto (p = F/A), per cui diminuendo l'area della superficie di contatto aumenta la pressione e di conseguenza il ghiaccio sottostante fonde più facilmente, per cui l'attrito è minore. Per tale motivo le lame dei pattini da ghiaccio devono essere molto sottili.
L'attrito inoltre genera calore, il quale contribuisce in parte alla formazione dello straterello di acqua.
Perché si possa scivolare sul ghiaccio infine la superficie del ghiaccio deve essere abbastanza liscia; tale condizione viene ad esempio soddisfatta se il ghiaccio si forma per lenta solidificazione di uno specchio d'acqua.
La teoria precedente non spiega comunque perché anche piccoli oggetti leggeri riescano a scivolare sul ghiaccio. Per tale motivo, tale teoria è stata superata da un'altra teoria secondo la quale il principale motivo della riduzione dell'attrito è legato al fatto che le molecole prossime alla superficie hanno una maggiore mobilità delle molecole del bulk (la parte del solido abbastanza lontana dalle regioni del solido stesso in cui avvengono gli scambi di materia, quantità di moto e calore, da non percepirne gli effetti), per cui permettono lo scivolamento.
Tipi di ghiaccio
[modifica | modifica wikitesto]Il ghiaccio e la neve con cui abbiamo a che fare normalmente ha una struttura cristallina esagonale definita ghiaccio Ih. Solo leggermente meno stabile (metastabile) della forma esagonale è quella cubica (ghiaccio Ic). Raffreddando ulteriormente il ghiaccio Ih si ottiene la formazione di una diversa configurazione nella quale si dispongono i protoni, la fase ghiaccio XI.
Sfruttando il raffreddamento e la pressione possono essere prodotti ulteriori tipi di ghiaccio, in funzione del diagramma di fase del ghiaccio. Finora sono note quindici fasi diverse che, oltre a quelle già citate comprendono la II, III, V, VI, VII, VIII, IX e X. Con attenzione, tutti questi tipi (eccetto la fase X) possono essere riportati a temperatura ambiente. I vari tipi differiscono per la loro struttura cristallina, ordinamento e densità.

Due fasi del ghiaccio sono metastabili: la IV e la XII. Il ghiaccio XII venne scoperto nel 1996. Nel 2006 sono state scoperte le fasi XIII e XIV.[1] Il ghiaccio XI, XIII e XIV sono forme ordinate rispettivamente del ghiaccio Ih, V e XII. Nel 2009 fu trovato il ghiaccio XV a pressioni estremamente elevate alla temperatura di −143 °C.[2] Si ritiene che a pressioni ancora più elevate il ghiaccio assuma una struttura metallica; la pressione necessaria è stimata attorno a 1,55 TPa[3] o 5,62 TPa.[4]
Oltre alla fase cristallina, l'acqua solidificata può esistere in stati amorfi: acqua solida amorfa, ghiaccio amorfo a bassa densità, ghiaccio amorfo ad alta densità, ghiaccio amorfo ad altissima densità e acqua vetrosa sottoraffreddata.
La brina è un tipo di ghiaccio che si forma per brinamento (che è appunto il termine tecnico per il passaggio diretto dallo stato aeriforme a quello solido) del vapore presente nell'aria a contatto con oggetti freddi. Essa contiene un'alta porzione di aria intrappolata, che la fa apparire bianca invece che trasparente e le conferisce una densità che è circa un quarto di quella del ghiaccio puro. La galaverna si forma invece per il congelamento delle gocce d'acqua contenute nella nebbia sulle superfici, quando la temperatura è inferiore a 0 °C.
Il ghiaccio può anche formare ghiaccioli, simili come aspetto alle stalattiti, quando l'acqua gocciola e si ricongela.
I clatrati idrati sono forme di ghiaccio che contengono molecole di gas intrappolate nella sua struttura cristallina. Il ghiaccio a frittelle (pancake ice) è una formazione di ghiaccio creata generalmente in zone con condizioni meno calme.
Alcune miscele di ghiaccio e segature di legno, chiamate "pykrete", esibiscono maggiori doti di resistenza meccanica rispetto al ghiaccio comune.
Alcune altre sostanze (in particolare forme solide di sostanze che si trovano solitamente come fluidi) vengono anch'esse chiamate "ghiaccio": il ghiaccio secco, ad esempio, è il termine con cui ci si riferisce comunemente al biossido di carbonio allo stato solido.
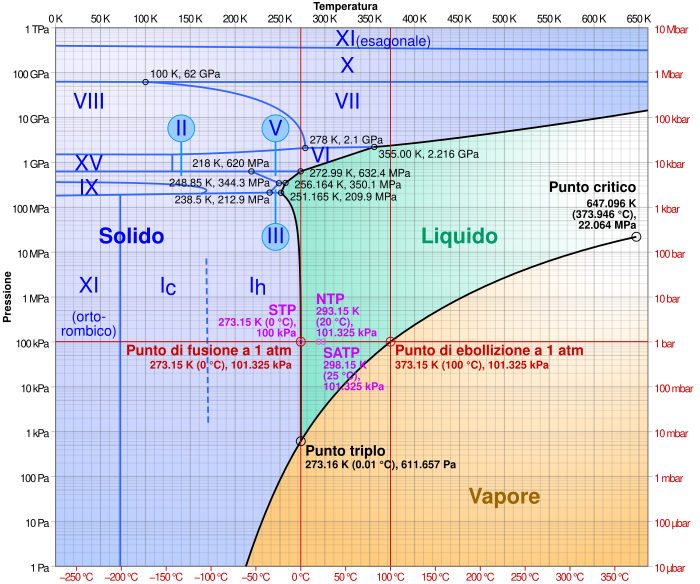
| Fase | Caratteristiche |
|---|---|
| Ghiaccio amorfo | Il ghiaccio amorfo è un tipo di ghiaccio privo di struttura cristallina. Esso esiste in tre forme: ghiaccio amorfo a bassa densità (LDA), formato alla pressione atmosferica o al di sotto di questa, ad alta densità (HDA) e ad altissima densità (VHDA), che si formano a pressioni più elevate. L'LDA si forma mediante il raffreddamento estremamente rapido dell'acqua liquida ("acqua vetrosa superraffreddata", HGW), mediante il deposito del vapore acqueo su substrati molto freddi ("acqua solida amorfa", ASW) o mediante il riscaldamento di forme di ghiaccio ad alta densità a pressione ambiente (LDA). |
| Ghiaccio Ih | Normale ghiaccio cristallino esagonale. Virtualmente tutto il ghiaccio nella biosfera è ghiaccio Ih, con la sola eccezione di una piccola quantità di ghiaccio Ic. |
| Ghiaccio Ic | Una variante cristallina cubica metastabile del ghiaccio. Gli atomi di ossigeno sono disposti in una struttura simile al diamante. È prodotto a temperature fra 130 e 220 K (−140 e −50 °C), e può esistere fino a 240 K,[5][6] quando si trasforma in ghiaccio Ih. Può essere occasionalmente presente nell'atmosfera superiore.[7] |
| Ghiaccio II | Una forma cristallina romboedrica con struttura altamente ordinata. Formato dal ghiaccio Ih comprimendolo alla temperatura di 190–210 K. Quando è riscaldato, subisce la trasformazione in ghiaccio III. |
| Ghiaccio III | Un ghiaccio cristallino tetragonale, formato raffreddando l'acqua fino a 250 K a 300 MPa. La meno densa delle fasi ad alta pressione. Più denso dell'acqua. |
| Ghiaccio IV | Una fase romboedrica metastabile. Si può formare riscaldando il ghiaccio amorfo ad alta densità lentamente a una pressione di 810 MPa. Non si forma facilmente senza un agente nucleante.[8] |
| Ghiaccio V | Una fase cristallina monoclina. Formato raffreddando l'acqua a 253 K a 500 MPa. La struttura più complessa di tutte le fasi.[9] |
| Ghiaccio VI | Una fase cristallina tetragonale. Formato raffreddando l'acqua a 270 K a 1,1 GPa. Esibisce il rilassamento di Debye.[10] |
| Ghiaccio VII | Una fase cubica. Le posizioni degli atomi di idrogeno sono disordinate. Esibisce il rilassamento di Debye. I legami a idrogeno formano due reticoli interpenetranti. |
| Ghiaccio VIII | Una versione più ordinata del ghiaccio VII, dove gli atomi di idrogeno assumono posizioni fisse. Formato dal ghiaccio VII, raffreddando sotto 5 °C (278 K). |
| Ghiaccio IX | Una fase tetragonale. Formato gradualmente dal ghiaccio III raffreddandolo da 208 K a 165 K, stabile sotto 140 K e a pressioni fra 200 MPa e 400 MPa. Ha una densità di 1,16 g/cm³, leggermente più elevata del ghiaccio comune e dell'acqua. |
| Ghiaccio X | Ghiaccio simmetrico con protoni ordinati. Si forma a circa 70 GPa.[11] |
| Ghiaccio XI | Una forma di ghiaccio esagonale ortorombica, in equilibrio a bassa temperatura. È ferroelettrico. Il ghiaccio XI è considerato la configurazione più stabile del ghiaccio Ih. Il processo di trasformazione naturale è molto lento ed è stato trovato ghiaccio XI nel ghiaccio antartico vecchio da 100 a 10 000 anni. Quello studio indicava che la temperatura al di sotto della quale il ghiaccio XI si forma è −36 °C (240 K).[12] |
| Ghiaccio XII | Una fase cristallina tetragonale, metastabile, densa. Si osserva nello spazio di fase del ghiaccio V e del ghiaccio VI. Può essere preparato riscaldando il ghiaccio amorfo ad alta densità da 77 K a circa 183 K a 810 MPa. Ha una densità di 1,3 g/cm3 a 127 K (cioè, approssimativamente 1,3 volte più denso dell'acqua). |
| Ghiaccio XIII | Una fase cristallina monoclina. Formato raffreddando l'acqua al di sotto di 130 K a 500 MPa. La forma con i protoni ordinati del ghiaccio V.[13] |
| Ghiaccio XIV | Una fase cristallina ortorombica. Formato sotto 118 K a 1,2 GPa. La forma con i protoni ordinati del ghiaccio XII.[13] |
| Ghiaccio XV | La forma con i protoni ordinati del ghiaccio VI formato raffreddando l'acqua intorno ai 80–108 K a 1,1 GPa. |
| Ghiaccio XVI | La forma cristallina dell'acqua meno densa, topologicamente equivalente alla struttura vuota dei clatrati idrati sII. |
| Ghiaccio XVII[14] | Ghiaccio poroso in grado di assorbire alcuni gas tra cui l'idrogeno ottenuto ad alte pressione e stabile a pressione ambiente e a temperature inferiori a -153 °C[14]. |
| Ghiaccio XVIII | Forma conosciuta come ghiaccio superionico dove gli ioni ossigeno assumono una struttura cristallina e gli ioni idrogeno si muovono liberi all'interno. |
| Ghiaccio XIX | Un'altra forma ordinata per protoni di ghiaccio VI che si forma dal raffreddamento dell'acqua intorno ai 100 K e a una pressione approssimata di 2 GPa.[15] |
Il ghiaccio sulla Terra
[modifica | modifica wikitesto]

Le scorte di acqua dolce terrestri sono contenute per più del 90% nei ghiacci. Sono costituite di ghiaccio le precipitazioni solide dell'atmosfera terrestre quali i cristalli di ghiaccio ottenuti per cristallizzazione del vapore acqueo sui germi cristallini che si aggregano nei comuni fiocchi di neve, la grandine per solidificazione diretta delle goccioline d'acqua di nube, la galaverna, la brina, il gelicidio, il vetrone e il vetrato. Proprio dalla neve attraverso il processo di metamorfismo dei cristalli di ghiaccio si forma il ghiaccio puro compatto dei ghiacciai e delle calotte polari, mentre le banchise si originano direttamente per solidificazione dell'acqua marina. L'insieme dei ghiacci terrestri forma la criosfera. La disciplina che studia il ghiaccio come componente della crosta terrestre è la glaciologia.
Effetti e importanza
[modifica | modifica wikitesto]
Il disgelo dei ghiacciai e delle nevi montane alimenta i fiumi e i laghi a valle. Quasi tutti i ghiacciai della Terra stanno però arretrando. Le bianche superfici ghiacciate del nostro pianeta riflettono nello spazio il calore solare e riducono l'effetto serra. Quasi in ogni loro località anche le calotte polari e le banchise si stanno riducendo. L'aumento della superficie oceanica (sia a discapito delle calotte polari, sia per l'innalzamento del livello del mare nelle zone equatoriali) fa assorbire più calore solare e contribuisce al riscaldamento e alla fusione globale dei ghiacci (feedback). Inoltre la fusione dei ghiacciai causa l'esposizione al calore solare delle rocce più scure sottostanti assorbendo quindi più calore e provocando anche in questo caso un feedback.
Relazione con gli esseri umani
[modifica | modifica wikitesto]Quando il ghiaccio fonde, assorbe una quantità di energia (il calore latente di fusione) pari a quella necessaria a innalzare la temperatura di una massa equivalente d'acqua di 80 °C, mentre la sua temperatura rimane costante a 0 °C. Di conseguenza, il ghiaccio è stato per lungo tempo usato come efficace mezzo di raffreddamento.
Per tutto l'Ottocento fiorì un fiorente commercio mondiale del ghiaccio in particolare dagli Stati Uniti d'America, precursore fu Frederic Tudor.
Fino a tempi recenti, l'edificio del Parlamento ungherese usava ghiaccio raccolto in inverno dal lago Balaton come risorsa principale per il condizionamento dell'aria. Le ghiacciaie venivano usate per immagazzinare ghiaccio durante l'inverno in modo da preservare i generi deperibili durante l'estate, e i primi frigoriferi funzionavano con un blocco di ghiaccio conservato al loro interno. La produzione e l'uso di cubetti di ghiaccio o di ghiaccio tritato è comune per raffreddare le bevande.
L'uomo riuscì per la prima volta a far ghiacciare artificialmente una massa d'acqua, e quindi a produrre del ghiaccio in assenza di basse temperature esterne, ben prima dell'invenzione del frigorifero, esattamente nel 1775. Lo scozzese William Cullen ci riuscì aspirando l'aria da un serbatoio contenente dell'acqua, questo portò a una diminuzione della pressione interna che causò l'innalzamento della temperatura di solidificazione dell'acqua fino a superare la temperatura del liquido stesso, con la conseguente solidificazione in ghiaccio.[16]
Il ghiaccio gioca un ruolo importante anche nelle attività ricreative invernali, soprattutto con sport come il pattinaggio su ghiaccio, l'hockey su ghiaccio, il curling, e l'alpinismo sui ghiacciai.
Il ghiaccio può anche essere un ostacolo; per i porti vicini ai poli geografici, essere liberi dal ghiaccio è una necessità vitale. Esempi sono Murmansk (Russia), Pečenga (Russia, in precedenza in Finlandia) e Vardø. I porti che non sono liberi dal ghiaccio vengono aperti usando delle apposite navi rompighiaccio.
Letteratura
[modifica | modifica wikitesto]Un fittizio "ghiaccio-nove" compare nel racconto di Kurt Vonnegut intitolato Ghiaccio-nove. In realtà in chimica con la dizione ghiaccio IX (e altri numeri romani) si indica una fase solida con caratteristiche specifiche, stabile solo entro un certo campo di pressioni e temperature. A temperature e pressioni diverse la fase può esistere ancora, ma diviene metastabile, ovvero tende a trasformarsi spontaneamente nella fase stabile, tanto più rapidamente quanto più le condizioni si discostano dalla propria zona stabile. Per fare un esempio, scaldando l'acciaio fino a portarlo in fase austenitica e poi temprandolo, ovvero raffreddandolo rapidamente per bloccare la trasformazione, si ottiene una fase metastabile a pressione e temperatura ambiente. Questa fase metastabile è molto resistente e duttile. In particolare il vero ghiaccio IX non ha le proprietà dell'immaginario ghiaccio-nove di Vonnegut e non è stabile a pressione e temperatura ambiente.
Nel romanzo Il senso di Smilla per la neve la protagonista, grazie alla sua profonda conoscenza dei tipi di neve e ghiaccio, riesce a risolvere un caso di omicidio.
Nel maggio 2007 attorno alla stella nana rossa GJ 436 è stato individuato un pianeta extrasolare formato d'acqua. Sotto la superficie gassosa di questo pianeta si presume che dovrebbe esistere del ghiaccio in forma solida in configurazioni come la VIII o la X che sulla Terra sono riproducibili solo in laboratorio.[17]
Note
[modifica | modifica wikitesto]- ^ C.G. Salzmann, et al., The Preparation and Structures of Hydrogen Ordered Phases of Ice, in Science, vol. 311, n. 5768, 2006, pp. 1758–1761, Bibcode:2006Sci...311.1758S, DOI:10.1126/science.1123896, PMID 16556840.
- ^ Laurua Sanders, A Very Special Snowball, Science News, 11 settembre 2009. URL consultato l'11 settembre 2009 (archiviato dall'url originale il 14 settembre 2009).
- ^ B. Militzer and H. F. Wilson, New Phases of Water Ice Predicted at Megabar Pressures (PDF), in Physical Review Letters, vol. 105, 2010, p. 195701, Bibcode:2010PhRvL.105s5701M, DOI:10.1103/PhysRevLett.105.195701, arXiv:1009.4722. URL consultato il 23 gennaio 2013 (archiviato dall'url originale il 17 dicembre 2011).
- ^ J. M. MacMahon, Ground-State Structures of Ice at High-Pressures (PDF), Bibcode:2011arXiv1106.1941M, DOI:10.1103/PhysRevB.84.220104, arXiv:1106.1941.
- ^ B. J. Murray, Bertram, A. K., Formation and stability of cubic ice in water droplets, in Phys. Chem. Chem. Phys., vol. 8, n. 1, 2006, pp. 186–192, DOI:10.1039/b513480c, PMID 16482260. Bibcode 2006PCCP....8..186M.
- ^ B. J. Murray, The Enhanced formation of cubic ice in aqueous organic acid droplets, in Env. Res. Lett., vol. 3, n. 2, 2008, p. 025008, DOI:10.1088/1748-9326/3/2/025008. Bibcode 2008ERL.....3b5008M.
- ^ B. J. Murray, et al., The formation of cubic ice under conditions relevant to Earth's atmosphere, in Nature, vol. 434, n. 7030, 2005, pp. 202–205, DOI:10.1038/nature03403, PMID 15758996. Bibcode 2005Natur.434..202M.
- ^ Chaplin, Martin, Ice-four structure, su Water Structure and Science, 1º luglio 2007. URL consultato il 2 gennaio 2008.
- ^ Chaplin, Martin, Ice-five and ice-thirteen structures, su Water Structure and Science, 11 novembre 2007. URL consultato il 2 gennaio 2008.
- ^ Chaplin, Martin, Ice-six structure, su Water Structure and Science, 11 novembre 2007. URL consultato il 2 gennaio 2008.
- ^ Chaplin, Martin, Ice-seven and ice-ten structures, su Water Structure and Science, 26 ottobre 2007. URL consultato il 2 gennaio 2008.
- ^ Chaplin, Martin, Hexagonal ice structure, su Water Structure and Science, 11 novembre 2007. URL consultato il 2 gennaio 2008.
- ^ a b Chaplin, Martin, Ice-twelve and ice-fourteen structures, su Water Structure and Science, 1º luglio 2007. URL consultato il 2 gennaio 2008.
- ^ a b Il ghiaccio "italiano" per il futuro dell'energia pulita, in Tom's hardware, 7 novembre 2016. URL consultato il 7 novembre 2016 (archiviato dall'url originale l'8 novembre 2016).
- ^ Metcalfe, Tom. Exotic crystals of 'ice 19' discovered. https://www.livescience.com/exotic-ice-19-discovered.html.
- ^ Yunus A. Cengel, Introduction To Thermodynamics and Heat Transfer, McGraw-Hill Series in Finance, 2007.
- ^ Scoperto un pianeta di "ghiaccio bollente", su lescienze.espresso.repubblica.it, Le Scienze. URL consultato il 17 maggio 2007.
Bibliografia
[modifica | modifica wikitesto]- Alberto Grandi, L'incredibile storia della neve e della sua scomparsa. Dalle civiltà mesopotamiche al frigorifero, dai cocktail all'emergenza climatica, 2022, Aboca, Sansepolcro, ISBN 978 88 5523 160 2.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni di o su ghiaccio
Wikiquote contiene citazioni di o su ghiaccio Wikizionario contiene il lemma di dizionario «ghiaccio»
Wikizionario contiene il lemma di dizionario «ghiaccio» Wikimedia Commons contiene immagini o altri file su ghiaccio
Wikimedia Commons contiene immagini o altri file su ghiaccio
Collegamenti esterni
[modifica | modifica wikitesto]- ghiaccio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Mark F. Meier e George D. Ashton, ice, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) water ice, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) water ice, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Il diagramma di fase dell'acqua, comprese le varianti di ghiaccio, su its.caltech.edu.
- (EN) Webmineral voce sul ghiaccio, su webmineral.com.
- (EN) MinDat.org voce e dati sul ghiaccio, su mindat.org.
- Ghiaccio, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 3950 · LCCN (EN) sh85063965 · GND (DE) 4013994-3 · BNF (FR) cb11976453f (data) · J9U (EN, HE) 987007538548805171 · NDL (EN, JA) 00566627 |
|---|