Herpes zoster
| Herpes zoster | |
|---|---|
 | |
| Specialità | infettivologia, dermatologia e neurologia |
| Eziologia | Human herpesvirus 3 |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 053 |
| ICD-10 | B02 |
| MeSH | D006562 |
| MedlinePlus | 000858 |
| eMedicine | 1132465 |
| Sinonimi | |
| Fuoco di Sant'Antonio | |
L'herpes zoster, comunemente chiamato fuoco di sant'Antonio[1] (o fiamme di Satana), è una malattia virale a carico della cute e delle terminazioni nervose, causata dal virus della varicella infantile (varicella-zoster virus). L'herpes zoster non è la stessa malattia dell'herpes simplex, nonostante la somiglianza del nome (sia il virus della varicella zoster sia l'herpes simplex virus appartengono alla stessa sottofamiglia virale degli Alphaherpesvirinae). Il suo nome deriva da due parole greche, "serpente" e "cintura", che descrivono in modo molto appropriato una malattia dolorosa, come un serpente di fuoco che si annida all'interno del corpo e che a volte ha strascichi lunghi e invalidanti.[2] La malattia è caratterizzata da un'eruzione cutanea dolorosa con presenza di vescicole, solitamente limitata a un lato del corpo, spesso in una striscia.
In tutto il mondo il tasso di incidenza annuale di herpes zoster varia da 1,2 a 3,4 casi ogni 1.000 individui sani, aumentando a 3,9-11,8 all'anno per 1.000 persone tra gli individui con più di 65 anni.[3][4][5] Una larga parte di persone sviluppa l'herpes zoster almeno una volta nella vita, anche se di solito un'unica volta. In uno studio statunitense del 1960, il 50% degli individui che vivono fino a 85 anni ha avuto almeno un attacco, mentre l'1% ha avuto almeno due attacchi.[6] Il trattamento tramite farmaci antivirali può ridurre la gravità e la durata dell'herpes zoster.[3][7]
Etimologia del nome
[modifica | modifica wikitesto]Il fuoco di sant'Antonio è così chiamato perché, per la sua guarigione, veniva invocato sant'Antonio Abate e ciò era dovuto al suo culto taumaturgico sviluppatosi in Francia, almeno dal XII secolo, attorno a quelle che erano considerate le sue spoglie (da un certo momento in poi, nel sud della Francia, erano presenti tre corpi di Antonio).[8]
Antonio divenne l'eponimo assoluto della malattia solo a partire dall'Età moderna poiché, durante tutto il Medioevo, anche altri santi, per particolari ragioni culturali, furono privilegiati taumaturghi della malattia. In particolare, soprattutto in Francia, era la Vergine a essere invocata, come guaritrice, in diversi santuari.[9]
Scrive per esempio Lanfranco da Milano, chirurgo del XIII secolo, che il fuoco di sant'Antonio compariva negli arti e poteva essere l'esito di una complicazione sopravvenuta a malattie pustolose oppure poteva essere il risultato di un bendaggio troppo stretto realizzato per curare la frattura di un arto, oppure l'effetto di una prolungata esposizione delle estremità bagnate a un freddo molto intenso.
Epidemiologia e storia
[modifica | modifica wikitesto]Anche se per secoli non è mai stata messa in relazione con il virus della varicella, l'herpes zoster è una malattia conosciuta fin dall'antichità. Verso la fine del 1700, i dermatologi inglesi Robert Willan e Thomas Bateman divulgano le prime illustrazioni di lesioni dermatologiche.[10] Ma è nel corso del secolo successivo che si assiste a un'intensa pubblicazione di atlanti dermatologici, caratterizzati da incisioni acquarellate. Verso la metà e la fine del XIX secolo appaiono le prime ceroplastiche e fotografie. Nel 1868 a Parigi compare il primo atlante fotografico di malattie della pelle, per opera di Hardy e Montméja, e in esso vengono raffigurate numerose lesioni da herpes zoster.[11]
Fu nel 1965 il dott. Robert Edgar Hope-Simpson a suggerire che:[12]
«La distribuzione per età peculiare di zoster può in parte riflettere la frequenza con cui i diversi gruppi di età hanno riscontrato casi di varicella determinando così la conseguente spinta nella loro protezione anticorpale con cui i loro attacchi di zoster sono rinviati nel tempo»
sostenendo così l'ipotesi, oggi universalmente accettata, che il contatto dei bambini con il virus della varicella aumenta poi negli adulti l'immunità cellulo-mediata, che è in grado di rinviare o sopprimere l'herpes zoster. A conferma di ciò, uno studio di Thomas et al., mostrò che gli adulti di famiglie con i bambini avevano una minore incidenza di herpes zoster rispetto alle famiglie senza figli.[13]
Il virus della varicella zoster (VZV) ha un alto livello di infettività e possiede una prevalenza mondiale.[14]
L'herpes zoster non ha alcuna correlazione con la stagione e non si verifica in epidemie. Vi è, tuttavia, un forte rapporto con l'aumentare dell'età.[15][16] Il tasso di incidenza di herpes zoster va da 1,2 a 3,4 per 1.000 persone-anno tra gli individui sani, aumentando da 3,9 a 11,8 per 1.000 persone-anno tra quelli di più di 65 anni.[3][5] I tassi di incidenza sono simili in tutto il mondo.[3][5] Questo rapporto con l'età è stato dimostrato in molti paesi,[3][5][17][18][19][20] ed è attribuito alla diminuzione delle capacità immunitarie con l'invecchiamento.
Un altro fattore di rischio importante è l'immunocompromissione, di cui l'infezione da HIV è un importante esempio.[21][22] Altri fattori di rischio includono lo stress psicologico.[23][24][25] Le persone di colore sono a minor rischio di herpes zoster rispetto ai bianchi caucasici.[26][27] Non è chiaro se il rischio sia maggiore nelle donne. Altri potenziali fattori di rischio comprendono traumi e l'esposizione a immunotossine.[16][25]
Gli adulti con infezione latente VZV, che sono esposti a intermittenza a bambini con la varicella, ricevono una spinta immunitaria.[15][25] Questo incremento periodico per il sistema immunitario aiuta a prevenire l'herpes zoster nel tempo. Quando la vaccinazione di routine contro la varicella è stata introdotta negli Stati Uniti, la preoccupazione è stata per gli adulti più anziani, poiché non avrebbero più avuto questa spinta immunitaria e avrebbero visto aumentare la probabilità di soffrire di herpes zoster.
In uno studio è stato stimato che il 26% dei pazienti che contraggono l'herpes zoster presentino complicanze. La nevralgia posterpetica si sviluppa in circa il 20% dei pazienti.[28] Uno studio condotto sui dati del 1994 della California ha trovato tassi di ospedalizzazione di 2,1 per 100.000 persone-anno, tassi che salivano al 9,3 per 100.000 persone-anno su soggetti dai 60 anni in su.[29] Un precedente studio, realizzato nel Connecticut, ha rilevato un tasso di ospedalizzazione superiore. La differenza può essere dovuta alla prevalenza di HIV nel precedente studio o all'introduzione di farmaci antivirali in California prima del 1994.[30]
Eziologia
[modifica | modifica wikitesto]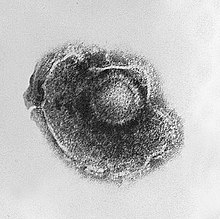
L'agente eziologico dell'herpes zoster è il virus varicella-zoster (VZV), un virus a doppia elica di DNA, della stessa famiglia dell'herpes simplex virus. La maggior parte delle persone sono infettate da questo virus da bambini, e soffrono di un episodio di varicella. L'herpes zoster è una ri-attivazione dell'infezione latente da VZV, e questo significa che lo zoster può verificarsi solo in individui che hanno già avuto la varicella. Il sistema immunitario è in grado di eliminare il virus nella maggior parte del corpo, ma esso rimane inattivo (o latente) nel ganglio adiacente al midollo spinale (chiamato ganglio dorsale) o nel ganglio semilunare di Gasser nella base del cranio.[31] Ripetuti attacchi di herpes zoster sono rari,[32] ed è estremamente raro che i pazienti possano sperimentare più di tre recidive.[31]
Anche se può verificarsi a qualsiasi età, circa la metà dei casi negli Stati Uniti hanno interessato soggetti di età maggiore di 50 anni.[4] A differenza dell'herpes simplex virus, la latenza del VZV è poco conosciuta. Sebbene il VZV sia stato rilevato in sede di autopsia del tessuto nervoso, non vi sono metodi per trovare il virus latente nei gangli delle persone viventi.[33]
Come con la varicella e/o altre forme di herpes, il contatto diretto con una eruzione cutanea attiva può diffondere il VZV a una persona che non possiede l'immunità al virus. L'individuo contagiato può quindi sviluppare varicella, ma non sviluppa l'herpes zoster immediatamente. Fino a quando il rash non si è tramutato in croste, la persona risulta estremamente contagiosa. Una persona è, inoltre, non infettiva prima della formazione di vesciche o durante la nevralgia posterpetica (il dolore che permane dopo la sparizione dell'eruzione).[32] Durante un caso di herpes zoster il virus solitamente non passa nel flusso sanguigno né nei polmoni e quindi non si può diffondere per via aerea.[2]
Non vi è una forte evidenza di un legame genetico o una correlazione alla storia familiare. Uno studio del 2008 ha dimostrato che le persone con parenti stretti che hanno avuto l'herpes zoster hanno il doppio delle probabilità di svilupparlo loro stessi,[34] ma uno studio del 2010 non ha confermato tali dati.[25]
Patogenesi
[modifica | modifica wikitesto]
Il virus della varicella zoster può diventare latente nei corpi delle cellule nervose e meno frequentemente nelle cellule non neuronali satellite del ganglio dorsale, dei nervi cranici o del sistema nervoso autonomo[35], senza provocare alcun sintomo.[36] Trascorsi anni o decenni dopo una infezione da varicella, il virus può uscire dai corpi cellulari nervosi e percorrere gli assoni causando infezione virale della cute nella regione servita dal nervo. Il virus può diffondersi da uno o più gangli lungo i nervi di un segmento interessato e infettare il corrispondente dermatomero (una zona di pelle servita da un nervo spinale), provocando una dolorosa eruzione cutanea.[37][38]
A meno che il sistema immunitario sia compromesso, esso è in grado di sopprimere la riattivazione del virus e di prevenire l'herpes zoster. Il perché questa repressione a volte non riesca è un argomento ancora poco conosciuto[4], ma si sa che è più probabile che ciò avvenga in persone il cui sistema immunitario è compromesso a causa di invecchiamento, di terapia immunosoppressiva, di stress psicologico, o di altri fattori.[16] Dopo la riattivazione, il virus si replica nelle cellule nervose e i virioni che si staccano dalle cellule seguono gli assoni verso la zona della pelle servita da tale ganglio. Nella pelle, il virus causa infiammazione locale e bolle. Il dolore a breve e lungo termine causato da herpes zoster deriva dalla crescita diffusa del virus nei nervi infetti e causa infiammazione.[39]
La formazione di caratteristiche vescicole e successivamente di croste è accompagnata da dolore, a volte molto intenso, dovuto al coinvolgimento di quelle strutture del sistema nervoso centrale e periferico che costituiscono il "sistema nocicettivo" (cioè della percezione del dolore). Di solito si manifesta sul torace o sull'addome, più raramente sul viso dove "predilige" il primo ramo del quinto nervo cranico (trigemino). In quest'ultimo caso, l'eruzione delle vescichette può interessare e danneggiare la cornea, condizione estremamente grave che può causare cecità.
Se la malattia è curata rapidamente con i farmaci antivirali, le vescicole evolvono in tempi più brevi in croste che successivamente cadono.
Complicanze
[modifica | modifica wikitesto]Anche se l'herpes zoster si risolve, in genere entro due settimane, possono sorgere alcune complicanze:
- nevralgia posterpetica: in particolare nelle persone anziane, è dovuta a un'alterazione del sistema nocicettivo, ed è caratterizzata da anestesia o ipoestesia "dolorosa", disestesie (prurito, formicolii, ecc.), allodinia (uno stimolo non doloroso viene percepito come doloroso) e iperalgesia (per abbassamento della soglia dolorosa)[40]. Come esattamente il virus rimanga latente nel corpo e successivamente si ri-attivi non è ancora stato compreso;[35]
- paralisi dei nervi cranici;
- coinvolgimento degli occhi: retinite, neurite retrobulbare;
- encefalomielite;
- infezioni batteriche secondarie;
- coinvolgimento motorio.
Coinvolgimenti del nervo trigemino (come si vede nell'herpes oftalmico) devono essere trattati precocemente e in maniera aggressiva, in quanto possono portare alla cecità. Il coinvolgimento della punta del naso, è un forte predittivo di herpes oftalmico.[41]
Sintomi
[modifica | modifica wikitesto]Segni e sintomi
[modifica | modifica wikitesto]| Giorno 1 | Giorno 2 | Giorno 5 | Giorno 6 |
|---|---|---|---|

|

|

|

|
I primi sintomi dell'herpes zoster, che includono mal di testa, febbre e malessere diffuso, non sono specifici e possono portare perciò a una diagnosi errata.[3][42] Questi sintomi sono generalmente seguiti da sensazioni di bruciore, prurito, iperestesia (ipersensibilità) o parestesie (formicolio, pizzicore, o torpore).[32] Il dolore può essere da lieve a molto intenso nel dermatomero interessato, con sensazioni che vengono spesso descritte come dolore trafittivo o bruciore, formicolio, intorpidimento, e possono essere intervallati da rapidi colpi di intenso dolore.[23] Si associa anche linfoadenopatia.
L'herpes zoster nei bambini è spesso indolore, ma gli anziani hanno più probabilità di sviluppare lo zoster man mano che invecchiano e la malattia tende a essere più grave.[15]
Nella maggior parte dei casi dopo 1-2 giorni, ma talvolta fino a 3 settimane, la fase iniziale viene seguita dalla comparsa di rash cutaneo caratteristico. Il dolore e il rash cutaneo più comunemente si verificano sui dermatomeri toracici medio-bassi o lombari superiori, ma possono apparire anche sul viso, soprattutto sugli occhi, o su altre parti del corpo. Dapprima l'eruzione cutanea appare simile all'orticaria, tuttavia, a differenza di quest'ultima, l'herpes zoster provoca alterazioni cutanee limitate a un unico dermatomero.[32] Lo zoster sine herpete (zoster senza herpes) descrive un paziente che ha tutti i sintomi dell'herpes zoster, tranne la caratteristica eruzione cutanea.[43]
In seguito, il rash diviene vescicolare, formando piccole vescicole piene di un essudato sieroso, mentre la febbre e il malessere continuano a presentarsi. Infine le vescicole si riempiono di sangue e si forma una crosta entro 10-15 giorni. Di solito le croste cadono e la pelle guarisce. A volte, in seguito a grandi vesciche, rimangono cicatrici e la pelle scolorita.[32]
L'herpes zoster può presentare sintomi aggiuntivi, a seconda del dermatomero coinvolto. L'herpes oftalmico coinvolge l'orbita dell'occhio e si verifica in circa il 10-25% dei casi. È causata dal virus riattivato nella branca oftalmica del nervo trigemino. In alcuni pazienti, i sintomi possono includere congiuntivite, cheratite, uveite e paralisi del nervo ottico che a volte possono causare l'infiammazione oculare cronica, la perdita della vista e dolore debilitante.[44] L'herpes zoster oticus (conosciuto anche come sindrome di Ramsay Hunt tipo II) coinvolge l'orecchio. Si pensa che sia il risultato della diffusione del virus dal nervo facciale al nervo vestibolococleare. I sintomi comprendono la perdita dell'udito e vertigini.[35]
Esami di laboratorio e strumentali
[modifica | modifica wikitesto]Esami di laboratorio sono disponibili per la diagnosi dell'herpes zoster. Il test più popolare rileva nel sangue gli anticorpi IgM VZV specifici. Questi anticorpi sono presenti solo durante i casi di varicella o di herpes zoster conclamato, ma non mentre il virus è dormiente.[45] Nei laboratori più attrezzati, la linfa raccolta da un bolla viene sottoposta a reazione a catena della polimerasi (PCR) per la ricerca del DNA del virus herpes zoster, o viene esaminata con un microscopio elettronico per esaminare le particelle virali.[46]
È stato recentemente effettuato uno studio su campioni di lesioni della pelle, occhi e polmoni di 182 pazienti con presunto herpes simplex o herpes zoster. Questi campioni sono stati testati con una real time PCR o tramite una coltura virale. In questo confronto, la coltura virale ha rilevato il VZV con una sensibilità del solo 14,3%, sebbene il test sia risultato altamente specifico (specificità = 100%). In confronto, la real time PCR ha dato un risultato del 100% sia in sensibilità, sia in specificità. Il risultato complessivo ha dimostrato un miglioramento del 60,4% delle tecniche PCR rispetto alla coltura virale per la diagnosi dell'herpes simplex e dell'herpes zoster.[47]
Diagnosi differenziale
[modifica | modifica wikitesto]
Se appare l'eruzione, l'identificazione della malattia (tramite diagnosi differenziale) richiede solo un esame visivo, dal momento che pochissime patologie producono eruzioni cutanee che interessano un dermatomero. Tuttavia, anche l'herpes simplex virus (HSV) può occasionalmente produrre una eruzione cutanea confinata in un dermatomero. Il test di Tzanck è utile per diagnosticare un'infezione acuta da virus dell'herpes, ma non distingue tra HSV e VZV.[48]
Quando l'eruzione è assente (fase precoce o tardiva della malattia o nel caso di zoster sine herpete, un'infezione da zoster ma senza eruzioni cutanee), l'herpes zoster può essere difficile da diagnosticare.[49] A parte il rash, la maggior parte dei sintomi della patologia possono verificarsi anche in altre condizioni mediche.
Trattamento
[modifica | modifica wikitesto]Gli obiettivi del trattamento per l'herpes zoster sono focalizzati a limitare l'intensità del dolore, a ridurre la durata dell'episodio e a evitare le complicanze. Il trattamento sintomatico si rende spesso necessario per la complicanza di nevralgia posterpetica.[50] Tuttavia, uno studio sul trattamento dell'herpes zoster mostra che, una volta che l'eruzione è avvenuta, la nevralgia post-erpetica è molto rara nelle persone sotto i 50 anni e svanisce nel tempo. Nelle persone anziane il dolore progredisce più lentamente, ma anche nelle persone oltre i 70 anni, l'85% era senza dolore a un anno dallo scoppio dell'herpes zoster.[51]
Per ridurre l'incidenza della nevralgia post-erpetica bisogna:[52]
- utilizzare sufficienti dosi di analgesici nella fase acuta (consenso non univoco);
- ridurre quanto prima la reazione infiammatoria.
Trattamento farmacologico
[modifica | modifica wikitesto]Analgesici
[modifica | modifica wikitesto]Le persone con un dolore che va da lieve a moderato possono essere trattati con analgesici "da banco". Lozioni topiche contenenti calamina possono essere utilizzate sull'eruzione o sulle vescicole e possono lenire il dolore. Di tanto in tanto, se il dolore è molto intenso, può essere necessario somministrare un farmaco oppioide, come la morfina. Una volta che le lesioni fanno la crosta, una crema con capsaicina (Zostrix) può essere utilizzata. Lidocaina topica e il blocco del nervo possono ridurre il dolore.[53] La somministrazione di gabapentin con antivirali può offrire un sollievo alla nevralgia post-erpetica.[50]
Antivirali
[modifica | modifica wikitesto]
I farmaci antivirali inibiscono la replicazione del virus varicella-zoster e riducono la gravità e la durata dell'herpes zoster con minimi effetti collaterali, ma non impediscono efficacemente il verificarsi della nevralgia posterpetica. Solitamente si usa l'aciclovir, un antivirale attivo nell'inibire la DNA polimerasi, sia per uso topico sia sistemico. Più recentemente sono usati in terapia il valaciclovir, il famciclovir, il penciclovir e il brivudin antivirali dotati di una migliore farmacocinetica.[50] Altri farmaci solitamente usati topicamente nella terapia e nella prevenzione delle complicanze oculari (cheratite erpetica) sono: la vidarabina, l'idoxuridina e la trifluorotimidina.[54]
I farmaci vengono utilizzati sia come profilassi (per esempio nei pazienti affetti da AIDS) sia come terapia durante la fase acuta. Il trattamento antivirale è raccomandato a tutti i soggetti immunocompetenti con herpes zoster di più di 50 anni, preferenzialmente entro 72 ore dalla comparsa dell'eruzione cutanea.[55] Le complicanze nei soggetti immunocompromessi con herpes zoster possono essere ridotte con la somministrazione di aciclovir per via endovenosa. Nelle persone che sono ad alto rischio per i ripetuti attacchi di herpes zoster, cinque dosi giornaliere orali di aciclovir risultano solitamente efficaci.[35]
Steroidi
[modifica | modifica wikitesto]La somministrazione per via orale di corticosteroidi è frequentemente utilizzata nel trattamento dell'infezione, anche se alcuni studi clinici hanno dimostrato come questo trattamento sia poco efficace. Tuttavia, uno studio effettuato su pazienti immunocompetenti di età superiore ai 50 anni di età, con herpes zoster localizzato, ha suggerito che la somministrazione di prednisone con aciclovir riduce il tempo di guarigione e migliora la qualità della vita.[56] Nella valutazione su un mese, l'aciclovir con prednisone ha aumentato la probabilità della formazione di croste e raddoppiato la guarigione delle lesioni di circa il doppio rispetto al placebo.
Questo studio ha anche valutato, in un mese, gli effetti di questa combinazione di farmaci sulla qualità della vita, dimostrando che i pazienti hanno meno dolore e hanno maggiori probabilità di poter interrompere l'uso di analgesici, di tornare alle attività abituali e di avere un sonno ininterrotto. Tuttavia, quando si confronta la cessazione del dolore associato a herpes zoster o alla nevralgia post-erpetica, non vi era alcuna differenza tra aciclovir e prednisone e aciclovir da solo. A causa dei rischi del trattamento con corticosteroidi, si raccomanda che questa combinazione di farmaci sia utilizzata solo nelle persone con più di 50 anni di età, a causa del maggiore rischio di sviluppo di nevralgia post-erpetica.[56]
Prognosi
[modifica | modifica wikitesto]
L'eruzione cutanea e il dolore solitamente regrediscono entro un periodo che va da tre a cinque settimane, ma circa un paziente su cinque sviluppa una condizione dolorosa chiamata nevralgia posterpetica, spesso di difficile gestione. In alcuni pazienti, l'herpes zoster può riattivarsi, presentandosi come zoster sine herpete con dolore irradiato lungo il decorso di un singolo nervo spinale (distribuzione dermatomerica), ma senza l'accompagnamento di un rash. Questa condizione può comportare complicanze che interessano diversi livelli del sistema nervoso e causare diverse neuropatie, polineuriti, mieliti o meningite asettica. Altri gravi effetti, che talvolta possono verificarsi, comprendono una parziale paralisi facciale (di solito temporanea), danni all'orecchio o encefalite.[35] Durante la gravidanza, i rischi per il feto, dovuti all'infezione primaria con il virus VZV che causa la varicella, non si verificano per l'infezione cronica o per la riattivazione dell'herpes zoster.[57][58]
Vi è un lieve incremento del rischio di sviluppare un tumore dopo un'infezione da herpes zoster. Tuttavia, il meccanismo non è chiaro e la mortalità da neoplasia non sembra aumentare come conseguenza diretta della presenza del virus.[59] Invece, il rischio può derivare dalla soppressione immunitaria che permette la sua riattivazione.[60]
Prevenzione
[modifica | modifica wikitesto]Esiste un vaccino vivo attenuato per l'herpes zoster: il suo nome commerciale è Zostavax.[61] Una review sistematica effettuata dalla Cochrane Library ha concluso che lo Zostavax è in grado di ridurre l'incidenza dell'herpes zoster di quasi il 50%.[62] Uno studio del 2007 ha rilevato che il vaccino ha un buon rapporto costo-efficacia negli Stati Uniti, prospettando un risparmio annuo che varia da 82 a 103 milioni di dollari, mentre un'analisi costi utilità è stimata essere compresa tra i 16.229 $ ai 27.609 $ Quality Adjusted Life Years (QALY).[63] Nel mese di ottobre 2007, il vaccino è stato ufficialmente raccomandato negli Stati Uniti per gli adulti sani di 60 anni di età.[61][64] Il Centers for Disease Control and Prevention statunitense raccomanda la somministrazione del vaccino agli individui di età superiore ai 60 anni, tuttavia non lo consiglia per il trattamento di herpes zoster attivi o della sindrome post-erpetica (dolore dopo la scomparsa del rash).[65] Gli adulti possono ricevere una risposta immunitaria dal contatto con i bambini affetti da varicella e ciò può consentire loro un potenziamento delle difese contro il virus che, in un quarto dei casi, impedisce la riattivazione dell'herpes zoster tra i non vaccinati. Tuttavia, essendo sempre più numerosi i bambini vaccinati contro la varicella, questa difesa per gli adulti sta diventando sempre meno comune.[7][66]
Nel Regno Unito e in altre parti d'Europa, l'immunizzazione di routine della popolazione contro la varicella non viene praticata.[67] Nel Regno Unito, la Health Protection Agency afferma che, nonostante il vaccino sia concesso in vendita, non vi sono piani per introdurre l'immunizzazione di routine nei bambini, anche se essa può essere offerta agli operatori sanitari che non hanno alcuna immunità al VZV.[68]
Uno studio del 2006, effettuato su 243 casi e su 483 controlli, ha trovato che il consumo di frutta fresca è associato a un ridotto rischio di sviluppare l'herpes zoster. Gli individui che avevano consumato meno di una porzione di frutta al giorno presentavano un rischio tre volte superiore rispetto a quelli che avevano consumato più di tre porzioni. Per quelli di età superiore ai 60 anni, si è rilevata una simile associazione tra vitamine e verdura.[69]
Nel gennaio 2022 Pfizer e BioNTech hanno annunciato una nuova collaborazione di ricerca, sviluppo e commercializzazione per sviluppare un potenziale primo vaccino a base di mRNA per la prevenzione del fuoco di Sant’Antonio (virus dell’herpes zoster o HZV).[70]
Note
[modifica | modifica wikitesto]- ^ Fuoco di Sant’Antonio (o Herpes Zoster): sintomi, cause e trattamenti, su doctolib.it.
- ^ a b Carlo Gelmetti, Il Fuoco Di Sant'antonio: Dai Misteri Eleusini All'lsd, Springer, 5 marzo 2010, pp. 78–, ISBN 978-88-470-1607-1.
- ^ a b c d e f Dworkin RH, Johnson RW, Breuer J et al., Recommendations for the management of herpes zoster, in Clin. Infect. Dis, 44 Suppl 1, 2007, pp. S1–26, DOI:10.1086/510206, PMID 17143845.
- ^ a b c Donahue JG, Choo PW, Manson JE, Platt R, The incidence of herpes zoster, in Arch. Intern. Med, vol. 155, n. 15, 1995, pp. 1605–9, DOI:10.1001/archinte.155.15.1605, PMID 7618983.
- ^ a b c d Araújo LQ, Macintyre CR, Vujacich C, Epidemiology and burden of herpes zoster and post-herpetic neuralgia in Australia, Asia and South America (PDF), in Herpes, vol. 14, Suppl 2, 2007, pp. 40A–4A, PMID 17939895. URL consultato il 4 giugno 2012 (archiviato dall'url originale il 16 dicembre 2008).
- ^ Hope-Simpson RE, The nature of herpes zoster; a long-term study and a new hypothesis, in Proc R Soc Med, vol. 58, n. 1, 1965, pp. 9–20, PMC 1898279, PMID 14267505.
- ^ a b Cunningham AL, Breuer J, Dwyer DE, Gronow DW, Helme RD, Litt JC, Levin MJ, Macintyre CR, The prevention and management of herpes zoster, in Med. J. Aust., vol. 188, n. 3, 2008, pp. 171–6, PMID 18241179.
- ^ A. Foscati, "I tre corpi del santo. Le leggende di traslazione delle spoglie di sant'Antonio abate in Occidente", in Hagiographica, XX (2013), pp. 143-181; Manteblog: I tre corpi del santo
- ^ A. Foscati, "La Vergine degli ‘Ardenti’. Aspetti di un culto taumaturgico nelle fonti mariane tra XII e XIII secolo", in Hagiographica, XVIII, 2011, pp. 263-295.
- ^ Weller TH, Chapter 1. Historical perspective, in Arvin AM, Gershon AA (a cura di), Varicella-Zoster Virus: Virology and Clinical Management, Cambridge University Press, 2000, ISBN 0-521-66024-6.
- ^ Oaklander AL, The pathology of shingles: Head and Campbell's 1900 monograph, in Arch. Neurol., vol. 56, n. 10, ottobre 1999, pp. 1292–4, DOI:10.1001/archneur.56.10.1292, PMID 10520948.
- ^ RE. HOPE-SIMPSON, The nature of herpes zoster: a long-term study and a new hypotesis., in Proc R Soc Med, vol. 58, gennaio 1965, pp. 9-20, PMID 14267505.
- ^ SL. Thomas, JG. Wheeler; AJ. Hall, Contacts with varicella or with children and protection against herpes zoster in adults: a case-control study., in Lancet, vol. 360, n. 9334, agosto 2002, pp. 678-82, DOI:10.1016/S0140-6736(02)09837-9, PMID 12241874.
- ^ Apisarnthanarak A, Kitphati R, Tawatsupha P, Thongphubeth K, Apisarnthanarak P, Mundy LM, Outbreak of varicella-zoster virus infection among Thai healthcare workers, in Infect Control Hosp Epidemiol, vol. 28, n. 4, 2007, pp. 430–4, DOI:10.1086/512639, PMID 17385149.
- ^ a b c Hope-Simpson RE, The nature of herpes zoster: a long-term study and a new hypothesis, in Proc R Soc Med, vol. 58, n. 1, 1965, pp. 9–20, PMC 1898279, PMID 14267505.
- ^ a b c Thomas SL, Hall AJ, What does epidemiology tell us about risk factors for herpes zoster?, in Lancet Infect Dis, vol. 4, n. 1, 2004, pp. 26–33, DOI:10.1016/S1473-3099(03)00857-0, PMID 14720565.
- ^ Brisson M, Edmunds WJ, Law B, et al., Epidemiology of varicella zoster virus infection in Canada and the United Kingdom, in Epidemiol Infect, vol. 127, n. 2, 2001, pp. 305–14, DOI:10.1017/S0950268801005921, PMC 2869750, PMID 11693508.
- ^ Insinga RP, Itzler RF, Pellissier JM, Saddier P, Nikas AA, The incidence of herpes zoster in a United States administrative database, in J Gen Intern Med, vol. 20, n. 8, 2005, pp. 748–53, DOI:10.1111/j.1525-1497.2005.0150.x, PMC 1490195, PMID 16050886.
- ^ Yawn BP, Saddier P, Wollan PC, St Sauver JL, Kurland MJ, Sy LS, A population-based study of the incidence and complication rates of herpes zoster before zoster vaccine introduction, in Mayo Clin Proc, vol. 82, n. 11, 2007, pp. 1341–9, DOI:10.4065/82.11.1341, PMID 17976353.
- ^ de Melker H, Berbers G, Hahné S, et al., The epidemiology of varicella and herpes zoster in The Netherlands: implications for varicella zoster virus vaccination, in Vaccine, vol. 24, n. 18, 2006, pp. 3946–52, DOI:10.1016/j.vaccine.2006.02.017, PMID 16564115.
- ^ Colebunders R, Mann JM, Francis H, et al., Herpes zoster in African patients: a clinical predictor of human immunodeficiency virus infection, in J Infect Dis, vol. 157, n. 2, 1988, pp. 314–318, DOI:10.1093/infdis/157.2.314.
- ^ Buchbinder SP, Katz MH, Hessol NA, et al., Herpes zoster and human immunodeficiency virus infection, in J Infect Dis, vol. 166, n. 5, 1992, pp. 1153–1156, DOI:10.1093/infdis/166.5.1153.
- ^ a b Katz J, Cooper EM, Walther RR, Sweeney EW, Dworkin RH, Acute pain in herpes zoster and its impact on health-related quality of life, in Clin. Infect. Dis, vol. 39, n. 3, 2004, pp. 342–8, DOI:10.1086/421942, PMID 15307000.
- ^ Livengood JM, The role of stress in the development of herpes zoster and postherpetic neuralgia, in Curr Rev Pain, vol. 4, n. 1, 2000, pp. 7–11, PMID 10998709.
- ^ a b c d Gatti A, Pica F, Boccia MT, De Antoni F, Sabato AF, Volpi A., No evidence of family history as a risk factor for herpes zoster in patients with post-herpetic neuralgia, in J Med Virol, vol. 82, n. 6, 2010, pp. 1007–11, DOI:10.1002/jmv.21748, PMID 20419815.
- ^ Schmader K, George LK, Burchett BM, Pieper CF, Racial and psychosocial risk factors for herpes zoster in the elderly, in J Infect Dis, vol. 178, Suppl 1, 1998, pp. S67–70, DOI:10.1086/514254, PMID 9852978.
- ^ Schmader K, George LK, Burchett BM, Hamilton JD, Pieper CF, Race and stress in the incidence of herpes zoster in older adults, in J Am Geriatr Soc, vol. 46, n. 8, 1998, pp. 973–7, PMID 9706885.
- ^ Volpi A, Severe complications of herpes zoster (PDF), in Herpes, vol. 14, Suppl 2, 2007, pp. 35A–9A, PMID 17939894. URL consultato il 4 giugno 2012 (archiviato dall'url originale il 27 gennaio 2019).
- ^ Coplan P, Black S, Rojas C, Incidence and hospitalization rates of varicella and herpes zoster before varicella vaccine introduction: a baseline assessment of the shifting epidemiology of varicella disease, in Pediatr Infect Dis J, vol. 20, n. 7, 2001, pp. 641–5, DOI:10.1097/00006454-200107000-00002, PMID 11465834.
- ^ Weaver BA, The burden of herpes zoster and postherpetic neuralgia in the United States, in J Am Osteopath Assoc, vol. 107, 3 Suppl, 1º marzo 2007, pp. S2–7, PMID 17488884 (archiviato dall'url originale il 13 gennaio 2008).
- ^ a b Steiner I, Kennedy PG, Pachner AR, The neurotropic herpes viruses: herpes simplex and varicella-zoster, in Lancet Neurol, vol. 6, n. 11, 2007, pp. 1015–28, DOI:10.1016/S1474-4422(07)70267-3, PMID 17945155.
- ^ a b c d e Stankus SJ, Dlugopolski M, Packer D, Management of herpes zoster (shingles) and postherpetic neuralgia, in Am Fam Physician, vol. 61, n. 8, 2000, pp. 2437–44, 2447–8, PMID 10794584. URL consultato il 3 giugno 2012 (archiviato dall'url originale il 29 settembre 2007).
- ^ Mitchell BM, Bloom DC, Cohrs RJ, Gilden DH, Kennedy PG, Herpes simplex virus-1 and varicella-zoster virus latency in ganglia (PDF), in J. Neurovirol, vol. 9, n. 2, 2003, pp. 194–204, DOI:10.1080/713831492, PMID 12707850.
- ^ Hicks LD, Cook-Norris RH, Mendoza N, Madkan V, Arora A, Tyring SK, Family history as a risk factor for herpes zoster: a case-control study, in Arch Dermatol, vol. 144, n. 5, maggio 2008, pp. 603–8, DOI:10.1001/archderm.144.5.603, PMID 18490586.
- ^ a b c d e Johnson, RW & Dworkin, RH, Clinical review: Treatment of herpes zoster and postherpetic neuralgia, in BMJ, vol. 326, n. 7392, 2003, pp. 748–50, DOI:10.1136/bmj.326.7392.748, PMC 1125653, PMID 12676845.
- ^ Kennedy PG, Varicella-zoster virus latency in human ganglia, in Rev. Med. Virol., vol. 12, n. 5, 2002, pp. 327–34, DOI:10.1002/rmv.362, PMID 12211045.
- ^ Peterslund NA, Herpesvirus infection: an overview of the clinical manifestations, in Scand J Infect Dis Suppl, vol. 80, 1991, pp. 15–20, PMID 1666443.
- ^ Gilden DH, Cohrs RJ, Mahalingam R, Clinical and molecular pathogenesis of varicella virus infection, in Viral Immunol, vol. 16, n. 3, 2003, pp. 243–58, DOI:10.1089/088282403322396073, PMID 14583142.
- ^ Schmader K, Herpes zoster and postherpetic neuralgia in older adults, in Clin. Geriatr. Med., vol. 23, n. 3, 2007, pp. 615–32, vii–viii, DOI:10.1016/j.cger.2007.03.003, PMID 17631237.
- ^ Dainty P., Prevention and medical management of postherpetic neuralgia., in Br J Hosp Med (Lond)., maggio 2008.
- ^ Herpes Zoster Ophthalmicus, su Merck Manual (Merk.com), ottobre 2008. URL consultato il giugno 2010.
- ^ Zamula E, Shingles: an unwelcome encore, in FDA Consumer, vol. 35, n. 3, maggio–giugno 2001, pp. 21–5, PMID 11458545. URL consultato il 5 gennaio 2010. Revised June 2005.
- ^ Furuta Y, Ohtani F, Mesuda Y, Fukuda S, Inuyama Y, Early diagnosis of zoster sine herpete and antiviral therapy for the treatment of facial palsy, in Neurology, vol. 55, n. 5, 2000, pp. 708–10, PMID 10980741.
- ^ Shaikh S, Ta CN, Evaluation and management of herpes zoster ophthalmicus, in Am Fam Physician, vol. 66, n. 9, 2002, pp. 1723–1730, PMID 12449270. URL consultato il 3 giugno 2012 (archiviato dall'url originale il 14 maggio 2008).
- ^ Arvin AM, Varicella-zoster virus (PDF), in Clin. Microbiol. Rev, vol. 9, n. 3, 1996, pp. 361–81, PMC 172899, PMID 8809466. URL consultato il 3 giugno 2012 (archiviato dall'url originale il 25 giugno 2008).
- ^ Beards G, Graham C, Pillay D, <155::AID-JMV1>3.0.CO;2-4 Investigation of vesicular rashes for HSV and VZV by PCR, in J. Med. Virol, vol. 54, n. 3, 1998, pp. 155–7, DOI:10.1002/(SICI)1096-9071(199803)54:3<155::AID-JMV1>3.0.CO;2-4, PMID 9515761.
- ^ Stránská R, Schuurman R, de Vos M, van Loon AM., Routine use of a highly automated and internally controlled real-time PCR assay for the diagnosis of herpes simplex and varicella-zoster virus infections, in J Clin Virol., vol. 30, n. 1, 2003, pp. 39–44, DOI:10.1016/j.jcv.2003.08.006, PMID 15072752.
- ^ Oranje AP, Folkers E, The Tzanck smear: old, but still of inestimable value, in Pediatr Dermatol, vol. 5, n. 2, 1988, pp. 127–9, DOI:10.1111/j.1525-1470.1988.tb01154.x, PMID 2842739.
- ^ Chan J, Bergstrom RT, Lanza DC, Oas JG, Lateral sinus thrombosis associated with zoster sine herpete, in Am J Otolaryngol, vol. 25, n. 5, 2004, pp. 357–60, DOI:10.1016/j.amjoto.2004.03.007, PMID 15334402.
- ^ a b c Tyring SK, Management of herpes zoster and postherpetic neuralgia, in J Am Acad Dermatol, vol. 57, 6 Suppl, 2007, pp. S136–42, DOI:10.1016/j.jaad.2007.09.016, PMID 18021865.
- ^ Sigurdur Helgason et al, Prevalence of postherpetic neuralgia after a single episode of herpes zoster: prospective study with long term follow up (PDF), in British Medical Journal, vol. 321, n. 7264, 2000, pp. 794–6, DOI:10.1136/bmj.321.7264.794, PMC 27491, PMID 11009518.
- ^ Wulf H, Baron R., Prevention of postherpetic neuralgia: does it exist?, in Schmerz., vol. 11, dicembre 1997, pp. 373-377..
- ^ Baron R, Post-herpetic neuralgia case study: optimizing pain control, in Eur. J. Neurol, 11 Suppl 1, 2004, pp. 3–11, DOI:10.1111/j.1471-0552.2004.00794.x, PMID 15061819.
- ^ Rugarli, p. 1502.
- ^ Breuer J, Whitley R, Varicella zoster virus: natural history and current therapies of varicella and herpes zoster (PDF), in Herpes, vol. 14, Suppl 2, 2007, pp. 25–9, PMID 17939892. URL consultato il 3 giugno 2012 (archiviato dall'url originale il 16 dicembre 2008).
- ^ a b Whitley RJ, Weiss H, Gnann JW, Tyring S, Mertz GJ, Pappas PG, Schleupner CJ, Hayden F, Wolf J, Soong SJ, Acyclovir with and without prednisone for the treatment of herpes zoster. A randomized, placebo-controlled trial. The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group, in Ann. Intern. Med., vol. 125, n. 5, 1996, pp. 376–83, PMID 8702088.
- ^ Paryani SG, Arvin AM, Intrauterine infection with varicella-zoster virus after maternal varicella, in N. Engl. J. Med., vol. 314, n. 24, 1986, pp. 1542–6, DOI:10.1056/NEJM198606123142403, PMID 3012334.
- ^ Enders G, Miller E, Cradock-Watson J, Bolley I, Ridehalgh M, Consequences of varicella and herpes zoster in pregnancy: prospective study of 1739 cases, in Lancet, vol. 343, n. 8912, 1994, pp. 1548–51, DOI:10.1016/S0140-6736(94)92943-2, PMID 7802767.
- ^ Sørensen HT, Olsen JH, Jepsen P, Johnsen SP, Schønheyder HC, Mellemkjaer L, The risk and prognosis of cancer after hospitalisation for herpes zoster: a population-based follow-up study, in Br. J. Cancer, vol. 91, n. 7, 2004, pp. 1275–9, DOI:10.1038/sj.bjc.6602120, PMC 2409892, PMID 15328522.
- ^ Ragozzino MW, Melton LJ, Kurland LT, Chu CP, Perry HO, Risk of cancer after herpes zoster: a population-based study, in N. Engl. J. Med., vol. 307, n. 7, 1982, pp. 393–7, DOI:10.1056/NEJM198208123070701, PMID 6979711.
- ^ a b Harpaz R, Ortega-Sanchez IR, Seward JF, Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP), in MMWR Recomm Rep, vol. 57, RR–5, 6 giugno 2008, pp. 1–30; quiz CE2–4, PMID 18528318. URL consultato il 4 gennaio 2010.
- ^ Gagliardi AM, Gomes Silva BN, Torloni MR, Soares BG, Vaccines for preventing herpes zoster in older adults, in Anna MZ Gagliardi (a cura di), Cochrane Database Syst Rev, vol. 10, 2012, pp. CD008858, DOI:10.1002/14651858.CD008858.pub2, PMID 23076951.
- ^ Pellissier JM, Brisson M, Levin MJ, Evaluation of the cost-effectiveness in the United States of a vaccine to prevent herpes zoster and postherpetic neuralgia in older adults, in Vaccine, vol. 25, n. 49, 2007, pp. 8326–37, DOI:10.1016/j.vaccine.2007.09.066, PMID 17980938.
- ^ Advisory Committee on Immunization Practices, Recommended adult immunization schedule: United States, October 2007 – September 2008, in Ann Intern Med, vol. 147, n. 10, 20 novembre 2007, pp. 725–9, DOI:10.7326/0003-4819-147-10-200711200-00187, PMID 17947396.
- ^ Gilden D, Efficacy of live zoster vaccine in preventing zoster and postherpetic neuralgia, in J Intern Med, vol. 269, n. 5, febbraio 2011, pp. 496–506, DOI:10.1111/j.1365-2796.2011.02359.x, PMC 3083261, PMID 21294791.
- ^ Brisson M, Gay N, Edmunds W, Andrews N, Exposure to varicella boosts immunity to herpes-zoster: implications for mass vaccination against chickenpox, in Vaccine, vol. 20, 19–20, 2002, pp. 2500–7, DOI:10.1016/S0264-410X(02)00180-9, PMID 12057605.
- ^ NHS Direct, Why isn't the chickenpox vaccine available in the UK?, su nhsdirect.nhs.uk, 7 febbraio 2008. URL consultato il 22 marzo 2008 (archiviato dall'url originale il 23 aprile 2008).
- ^ Health Protection Agency, Chickenpox / Varicella — General Information, su hpa.org.uk, 11 maggio 2006. URL consultato il 22 marzo 2008 (archiviato dall'url originale il 19 luglio 2008).
- ^ Thomas SL, Wheeler JG, Hall AJ, Micronutrient intake and the risk of herpes zoster: a case-control study, in Int J Epidemiol, vol. 35, n. 2, 2006, pp. 307–14, DOI:10.1093/ije/dyi270, PMID 16330478.
- ^ Pfizer and BioNTech Sign New Global Collaboration Agreement to Develop First mRNA-based Shingles Vaccine, su investors.biontech.de.
Bibliografia
[modifica | modifica wikitesto]- Stephen L. Hauser, Harrison: Neurologia clinica, Casarile (Milano), McGraw-Hill, 2007, ISBN 978-88-386-3923-4.
- Carlo Gelmetti, Il fuoco di Sant'Antonio. Storia, tradizioni e medicina, Milano, Springer-Verlag, 2007, ISBN 88-470-0594-9.
- Claudio Rugarli, Medicina interna sistematica, Amsterdam, 2010, ISBN 88-214-3109-6.
- A. Foscati, Ignis sacer. Una storia culturale del ‘fuoco sacro’ dall'antichità al Settecento, (Micrologus' Library, 51) Firenze, 2013 isbn 978-88-8450-469-2
- E. Wichersheimer, "«Ignis sacer» – variazioni del suo significato nosografico nel corso dei secoli", in Symposium Ciba, 4 (1960), pp. 160–69.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su herpes zoster
Wikimedia Commons contiene immagini o altri file su herpes zoster
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) herpes zoster, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) NINDS Shingles Information Page Archiviato il 27 luglio 2016 in Internet Archive., National Institute of Neurological Disorders and Stroke
- (EN) Links to pictures of Shingles (Hardin MD) University of Iowa
- (EN) Facts About The Cornea and Corneal Disease: Herpes Zoster (Shingles), National Eye Institute
- Portale dedicato alla malattia dell'herpes zoster
| Controllo di autorità | Thesaurus BNCF 24289 · LCCN (EN) sh85060456 · GND (DE) 4158514-8 · BNE (ES) XX549608 (data) · J9U (EN, HE) 987007558049805171 |
|---|