Ossidoriduzione
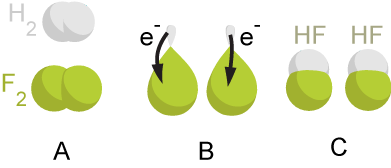
Ossidoriduzione o redox (composto dall'inglese reduction, riduzione e oxidation, ossidazione), in chimica, indica tutte quelle reazioni chimiche in cui cambia il numero di ossidazione degli atomi, cioè in cui si ha un passaggio di elettroni da una specie chimica a un'altra.[1]
Questo tipo di reazione può variare da un semplice processo redox (come l'ossidazione del carbonio che genera diossido di carbonio o la riduzione del carbonio dall'idrogeno che produce metano), fino alla più complessa ossidazione degli zuccheri nel corpo umano, attraverso una serie di complicati processi di trasferimento degli elettroni.
Riduzione e ossidazione
[modifica | modifica wikitesto]Una reazione redox può essere pensata come lo svolgersi contemporaneo di due distinte "semireazioni":[1]
- ossidazione: si manifesta come aumento del numero di ossidazione di una specie chimica (per esempio molecola, atomo o ione), in genere dovuto a una cessione di elettroni da parte della specie considerata.[1] La specie chimica che perde elettroni è detta "riducente".
- riduzione: si manifesta come una diminuzione del numero di ossidazione di una specie chimica, in genere dovuta a un'acquisizione di elettroni da parte della specie.[1] La specie chimica che acquista elettroni è detta "ossidante".
Quindi le semireazioni di riduzione e di ossidazione comportano sempre un cambiamento nel numero di ossidazione; in particolare un'ossidazione comporta un incremento del numero di ossidazione, mentre una riduzione comporta una diminuzione del numero di ossidazione.[1]
Le semireazioni di riduzione e ossidazione possono essere rappresentate nel seguente modo:[2]
- Semireazione di riduzione: specie ossidante + ne− → specie ridotta
- Semireazione di ossidazione: specie riducente → specie ossidata + ne−
essendo n il numero (o le moli) di elettroni scambiati durante la reazione, è uguale in entrambe le semireazioni.
La reazione redox globale può essere quindi rappresentata come:
- specie ossidante + specie riducente → specie ossidata + specie ridotta
In elettrochimica, le specie chimiche coinvolte direttamente nel processo di trasferimento di elettroni vengono dette «specie elettroattive», per distinguerle da eventuali altre specie chimiche presenti nel sistema che non subiscono riduzione o ossidazione.
Bilanciamento delle reazioni di ossidoriduzione
[modifica | modifica wikitesto]Le reazioni chimiche di ossidoriduzione possono essere bilanciate con vari metodi, tra cui il "metodo ionico-elettronico". Questo metodo consiste nei seguenti passaggi:
- scrivere i numeri di ossidazione delle specie chimiche per individuare l'ossidante e il riducente;
- dissociare le sostanze elettroliti e prenderle in considerazione così come realmente si trovano in soluzione;
- bilanciare la valenza dell'elemento mediante l'aggiunta di elettroni;
- bilanciare la carica dello ione mediante l'aggiunta di ioni H+ (se si è in ambiente acido) oppure di OH− (se si è in ambiente basico);
- bilanciare la massa degli idrogeni con l'aggiunta di H2O;
- moltiplicare le reazioni di ossidazione per il numero di elettroni della riduzione e viceversa;
- sommare le due semireazioni facendo il minimo comune multiplo degli elettroni in modo che possano essere semplificati dal calcolo;
- se necessario, effettuare il bilanciamento degli ossigeni.
Meccanismo di reazione
[modifica | modifica wikitesto]Una reazione redox può avvenire in due modi:[3]
- per "via chimica": mettendo in contatto diretto la specie chimica che si riduce con quella che si ossida; in tal caso la reazione avviene "in fase omogenea" (cioè in un'unica fase);[4]
- per "via elettrochimica": separando in due compartimenti le sostanze che si debbono scambiare gli elettroni, i quali vengono fatti passare attraverso un conduttore che collega i due compartimenti; in tal caso la reazione avviene "in fase eterogenea" (cioè all'interfaccia tra due fasi).[4]
Nel caso di reazione in fase eterogenea all'interfaccia elettrodo-elettrolita, la reazione redox è preceduta e seguita da diversi stadi di reazione, per cui il meccanismo di reazione è in genere costituito dai seguenti stadi di reazione:[5][6]
- "trasferimento di massa" di alcuni reagenti dal bulk dell'elettrolita all'interfaccia elettrodo-elettrolita;[7]
- adsorbimento sulla superficie dell'elettrodo di alcuni reagenti;
- reazione redox; tale stadio è anche detto "trasferimento di carica", in quanto durante la reazione redox si ha uno scambio di elettroni tra due specie chimiche;
- desorbimento dalla superficie dell'elettrodo di alcuni prodotti;
- "trasferimento di massa" di alcuni prodotti dall'interfaccia elettrodo-elettrolita al bulk dell'elettrolita;
- cristallizzazione di alcuni prodotti sulla superficie dell'elettrodo;
- svolgimento di reazioni chimiche secondarie prima o dopo la reazione redox;
- trasferimento di massa di alcuni reagenti e prodotti all'interno del bulk dell'elettrolita.
A ciascuno di questi stadi è associata una sovratensione, cioè una variazione del potenziale di cella rispetto alle condizioni di equilibrio. In particolare si ha:
- sovratensione per trasferimento di carica (associata alla reazione redox);
- caduta ohmica (associata al trasporto di materia nel bulk dell'elettrolita);
- sovratensione di cristallizzazione;
- sovratensione per reazione chimica.
Allo stadio cineticamente determinante è associata la sovratensione più elevata.
Applicazioni
[modifica | modifica wikitesto]
Le reazioni di ossidoriduzione sono alla base di moltissimi processi biochimici essenziali alla vita (un esempio è la respirazione) e sono sfruttate per la produzione di composti chimici (ad esempio nel processo cloro-soda per ottenere cloro e idrossido di sodio) e nell'ambito della chimica elettroanalitica.
Se i reagenti vengono mantenuti separati ma viene garantito il contatto elettrico tramite materiali conduttori, è possibile intercettare il flusso di elettroni e sfruttarlo per produrre corrente elettrica continua, il cui potenziale dipende dalla natura chimica delle specie coinvolte. Tale principio viene sfruttato nella pila.
Una reazione di ossidoriduzione può avvenire spontaneamente o essere forzata in senso inverso tramite l'applicazione di un opportuno potenziale elettrico. Questo fenomeno è ampiamente sfruttato nelle pile ricaricabili e nelle batterie per autotrazione (che fungono da accumulatori di energia elettrica sotto forma di energia chimica), nonché nel processo di elettrolisi.
Ossidoriduzione del carbonio
[modifica | modifica wikitesto]L'atomo di carbonio in natura si trova in differenti stati di ossidazione e in chimica organica il numero di ossidazione dipende da numerosi fattori; esso può essere anche frutto di una media che porta a un numero di ossidazione razionale (per esempio nel propino il numero di ossidazione medio dei carboni è pari a -4/3). Non si può quindi definire a priori una regola precisa, tuttavia generalmente il suo valore segue il seguente ordine:
- metano < alcani < alcheni < alcoli < alchini < aldeidi < chetoni < acidi carbossilici < anidride carbonica
Dove il carbonio assume valore +1 quando è legato con un elemento più elettronegativo, 0 quando è legato con un altro carbonio e -1 quando è legato con un elemento più elettropositivo: il carbonio avrà quindi numero di ossidazione pari a -4 nel metano e a +4 nell'anidride carbonica.
In generale quindi la concezione di ossidoriduzione in chimica organica è molto diversa rispetto a quella comune, sebbene il meccanismo sia analogo; infatti per riduzione di un carbonio generalmente si intende l'addizione di un idrogeno o di un elemento più elettropositivo del carbonio, come nell'idrogenazione di un alchene, mentre per ossidazione si intende l'addizione di un ossigeno o generalmente di un elemento più elettronegativo del carbonio, come in un'epossidazione.
Gli atomi di carbonio a diverso grado di ossidazione nel catabolismo ossidativo vengono portati al grado massimo di ossidazione (CO2) con recupero di energia (processo di respirazione). Il processo inverso invece che prevede l'anabolismo riduttivo del carbonio dell'anidride carbonica a carbonio organico è la fotosintesi clorofilliana.
In molti batteri questo non è possibile, in quanto non arrivano alla produzione di CO2, si fermano solamente agli alcoli. Questo processo dei batteri prende il nome di "fermentazione".
Quindi gli elettroni possono essere trasferiti da uno stato all'altro in quattro modi diversi:
- come singoli elettroni;
- come atomi di H;
- come ione idruro;
- con combinazione diretta con atomi di ossigeno.
Gli enzimi che catalizzano le reazioni di ossidoriduzione sono detti ossidoreduttasi. Alcuni importanti esempi di questa classe di enzimi sono le deidrogenasi e le flavoproteine. Le molecole che subiscono il processo di ossidoriduzione opposto (cioè si riducono se la sostanza organica si ossida, o viceversa) sono poche e sono detti "accettori di equivalenti riducenti". I più comuni sono: NAD, NADP, FAD, FMN.
Particolari tipi di reazioni redox
[modifica | modifica wikitesto]Nell'ambito delle reazioni redox esistono due tipi di reazione molto particolari: reazioni redox influenzate da pH e reazioni di dismutazione.
Le prime sono delle reazioni il cui andamento è influenzato dal pH della soluzione di partenza; ciò vuol dire che a seconda del pH si possono ottenere diversi prodotti a partire dagli stessi reagenti. Un esempio di queste reazioni è la reazione dello ione permanganato MnO−4, la cui soluzione è di colore violaceo:
- in ambiente acido la soluzione di reazione si scolorisce e vengono prodotti ioni manganese Mn2+, con una riduzione totale del numero di ossidazione di −5, quindi si ha un acquisto di 5 elettroni;
- in un ambiente neutro o leggermente basico si forma un precipitato di colore bruno, il diossido di manganese MnO2 mentre la colorazione della soluzione si scurisce; la riduzione totale è di −3 e quindi vengono acquistati altrettanti elettroni;
- in ambiente nettamente basico la soluzione assume una colorazione verde e vengono formati ioni manganato MnO2−4; la riduzione totale è di −1 e quindi si acquista un solo elettrone per ogni atomo di manganese.
Nei casi di queste reazioni particolari è quindi necessario specificare il pH dell'ambiente di reazione.
Il secondo particolare tipo di ossidoriduzioni sono le cosiddette reazioni di dismutazione o disproporzione; più precisamente queste reazioni sono caratterizzate dalla contemporanea ossidazione e riduzione di una stessa specie chimica. I prodotti sono quindi specie chimiche diverse contenenti lo stesso elemento iniziale che in parte si è ridotto e in parte si è ossidato. Per il loro bilanciamento esistono due metodi ugualmente validi: prendendo, ad esempio, la reazione KClO → KClO3 + KCl si può bilanciare così:
- 1º metodo
- si uguagliano i valori dell'ossidazione e della riduzione:
- ox:
Δ +4 - red:
Δ −2 ∙ 2 = 4
- ox:
- si inseriscono i coefficienti stechiometrici solo ai prodotti:
- si bilancia per confronto la reazione ottenuta:
- 2º metodo
-
- si scrivono le semireazioni di ossidazione e riduzione e si bilanciano le cariche:
- si uguagliano le due semireazioni e si sommano gli ioni aventi ugual carica:
- si eliminano gli elettroni adottati per il bilanciamento:
Note
[modifica | modifica wikitesto]- ^ a b c d e Washington University in St. Louis - Redox Reactions
- ^ Zanello, p. 12.
- ^ Elettrochimica (PDF), su chimica.unipd.it. URL consultato il 18 ottobre 2010 (archiviato dall'url originale il 30 maggio 2009).
- ^ a b Zanello, p. 7.
- ^ Kiehne, p. 11.
- ^ Zanello, pp. 12-13.
- ^ Per una rappresentazione dettagliata della struttura dell'interfaccia elettrodo-elettrolita, vedi la voce Doppio strato elettrico.
Bibliografia
[modifica | modifica wikitesto]- Paolo Silvestroni, Fondamenti di chimica, 10ª ed., CEA, 1996, pp. 102-109, ISBN 88-408-0998-8.
- (EN) Piero Zanello, Inorganic electrochemistry: theory, practice and applications, Royal Society of Chemistry, 2003, ISBN 0-85404-661-5.
- (EN) Heinz Albert Kiehne, Battery Technology Handbook, 2ª ed., CRC Press, 2003, ISBN 0-8247-5642-8.
- Elena Ghibaudi, Alberto Regis, Ezio Roletto, Le reazioni redox: un pasticcio concettuale?, in Perspectives in Science, vol. 5, Elsevier GmbH, ottobre 2015, pp. 14-24.
Voci correlate
[modifica | modifica wikitesto]- Potenziale standard di riduzione
- Diagramma di Ellingham
- Indicatore redox
- Teoria di Marcus
- Trasferimento di elettroni
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «ossidoriduzione»
Wikizionario contiene il lemma di dizionario «ossidoriduzione» Wikiversità contiene risorse sull'ossidoriduzione
Wikiversità contiene risorse sull'ossidoriduzione Wikimedia Commons contiene immagini o altri file sull'ossidoriduzione
Wikimedia Commons contiene immagini o altri file sull'ossidoriduzione
Collegamenti esterni
[modifica | modifica wikitesto]- Ossidoriduzióne / Redox, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- Ossidoriduzióne, in Dizionario delle scienze fisiche, Istituto dell'Enciclopedia Italiana, 1996.
- Simone Gelosa, Redox, in Enciclopedia della scienza e della tecnica, Istituto dell'Enciclopedia Italiana, 2007-2008.
- Ossidoriduzióne, su Vocabolario Treccani, Istituto dell'Enciclopedia Italiana.
- ossidoriduzióne, su sapere.it, De Agostini.
- (EN) Opere riguardanti Oxidation-reduction reaction / Oxidation-Reduction, su Open Library, Internet Archive.
- Reazioni di ossidoriduzione in becker, su itchiavari.org.
- Le reazioni di ossidoriduzione, su itchiavari.org.
- Esercizi sulle equazioni chimiche, su pc.ardoino.com. URL consultato il 5 febbraio 2009 (archiviato dall'url originale il 9 febbraio 2009).
| Controllo di autorità | Thesaurus BNCF 20982 · LCCN (EN) sh85096311 · GND (DE) 4177303-2 · BNF (FR) cb119794566 (data) · J9U (EN, HE) 987007555741305171 · NDL (EN, JA) 00570151 |
|---|





