Parowanie
Parowanie (ewaporacja) – zmiana stanu skupienia z ciekłego na gazowy (parę)[1], zachodzący z reguły na powierzchni cieczy. Może odbywać się w całym zakresie ciśnień i temperatur, w których mogą współistnieć z sobą obie fazy.
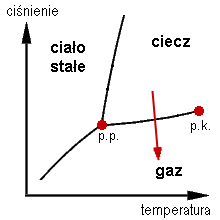
Szybkość procesu parowania zależy od temperatury oraz ciśnienia parcjalnego pary nad cieczą. Gdy ciśnienie pary jest równe ciśnieniu pary nasyconej w danej temperaturze, to parowanie nie zachodzi. Stan też określa się jako równowagę między parowaniem a skraplaniem. Obniżenie ciśnienia oraz napływ gazu o mniejszym stężeniu pary, zwiększa szybkość parowania. Gdy ciśnienie pary nasyconej zrówna się z ciśnieniem otoczenia, wówczas proces parowania – zwany wówczas wrzeniem – zaczyna zachodzić również w całej objętości cieczy.
Parowanie zachodzi wtedy, gdy cząsteczka ma dostatecznie wysoką energię kinetyczną, by wykonać pracę przeciwko siłom przyciągania między cząsteczkami cieczy.
Procesem odwrotnym do parowania jest skraplanie pary.
Proces parowania z bezpośrednim przejściem pomiędzy fazą stałą a parą nazywamy sublimacją.
Przemiany fazowe związane z parowaniem i sublimacją opisuje równanie Clapeyrona.
Podczas parowania w ciśnieniu znacznie niższym od ciśnienia krytycznego objętość substancji znacznie wzrasta.
Zobacz też
edytujPrzypisy
edytuj- ↑ parowanie, [w:] Encyklopedia PWN [online], Wydawnictwo Naukowe PWN [dostęp 2023-09-14].