Alkany
Alkany (parafiny, z łac. parum affinis = mało powinowaty[1][2]) – łańcuchowe węglowodory nasycone, organiczne związki chemiczne zbudowane wyłącznie z atomów węgla i wodoru, przy czym atomy węgla połączone są ze sobą wyłącznie wiązaniami pojedynczymi[3]. Ogólny wzór sumaryczny alkanów ma postać C
nH
2n+2.
Według obowiązującej systematyki IUPAC węglowe łańcuchy atomów w cząsteczkach alkanów mogą być zarówno proste, jak i rozgałęzione, jednak nie mogą tworzyć pierścieni ani zamkniętych pętli – cykloalkany nie są zatem alkanami[3][4].
Grupa alkanów uszeregowana według długości łańcuchów węglowych stanowi szereg homologiczny alkanów. Dalsze elementy tego szeregu określane są jako wyższe alkany (według różnych kryteriów jako wyższe alkany przyjmuje się np. homologi o łańcuchu >C6, >C10 lub >C16).
Rodzaje łańcuchów alkanów
[edytuj | edytuj kod]Alkany zawierające więcej niż trzy atomy węgla mogą tworzyć wiele izomerów konstytucyjnych różniących się rozgałęzieniami łańcuchów węglowych.
Łańcuchy proste
[edytuj | edytuj kod]Atomy węgla tworzą jeden nierozgałęziony łańcuch, na którego obydwu końcach znajdują się grupy metylowe.
Ze względu na możliwość rotacji wokół pojedynczych wiązań C−C, związki te mogą tworzyć izomery konformacyjne. Najniższą energię, a co za tym idzie, najwyższą trwałość mają konfromery, w których wiązania znajdują się w układzie naprzemianległym, a atomy węgla znajdują się w pozycjach antiperipalanarnych (trans). W warunkach normalnych zmiany konformacji alkanów następują bardzo szybko i nie można wyizolować poszczególnych konformerów[5].
Przykładowe konformacje naprzemianległe n-pentanu (deskryptory określają kąt torsyjny dla atomów C
1−C
2−C
3−C
4 i C
2−C
3−C
4−C
5):
-
trans-trans (antiperiplanarny-antiperiplanarny)
-
gauche-gauche (synklinalny-synklinalny)
-
trans-gauche (antiperiplanarny-synklinalny)
Łańcuchy rozgałęzione
[edytuj | edytuj kod]Co najmniej jeden z atomów węgla jest związany z więcej niż dwoma innymi atomami węgla, cała cząsteczka zawiera więcej niż dwie grupy metylowe.
Przykłady dla pięciu atomów węgla – rozgałęzione izomery konstytucyjne pentanu:
Liczba istniejących izomerów konstytucyjnych węglowodorów o łańcuchach rozgałęzionych rośnie bardzo szybko wraz z liczbą atomów węgla tworzących cząsteczkę. W powyższym przykładzie alkanów zawierających 5 atomów węgla, są to 3 izomery: n-pentan, izopentan i neopentan. Proste obliczenia kombinatoryczne (stabelaryzowane w OEIS) pozwalają wyznaczyć teoretyczną liczbę takich izomerów konstytucyjnych dla dowolnej liczby atomów węgla[6].
| Nazwa | Liczba izomerów |
|---|---|
| Metan | 1 |
| Etan | 1 |
| Propan | 1 |
| Butan | 2 |
| Pentan | 3 |
| Heksan | 5 |
| Heptan | 9 |
| Oktan | 18 |
| Nonan | 35 |
| Dekan | 75 |
| Undekan | 159 |
| Heksadekan | 10 359 |
| Nonatriakontan | 23 647 478 933 969 |
| Hektan | 59×1038 |
W praktyce część izomerów jest jednak niestabilna.
Łańcuchy cykliczne
[edytuj | edytuj kod]Zgodnie z systematyką IUPAC, cząsteczki zawierające łańcuchy cykliczne (cykloalkany, nazywane czasem alkanami cyklicznymi) formalnie nie należą do alkanów.
Właściwości
[edytuj | edytuj kod]Alkany są słabo rozpuszczalne w wodzie (rozpuszczalność rzędu kilkudziesięciu miligramów na litr), rozpuszczają się w rozpuszczalnikach organicznych. Są mało reaktywne ze względu na dużą trwałość wiązań C−C i C−H. Podobne właściwości do alkanów mają również cykloalkany (z wyjątkiem cyklopropanu i cyklobutanu, które są nietrwałe z powodu silnych naprężeń w małych pierścieniach ich cząsteczek).
Stany skupienia
[edytuj | edytuj kod]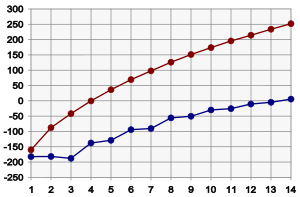
W zależności od temperatury oraz ciśnienia każdy z alkanów może być gazem, cieczą lub ciałem stałym. Temperatury przejść fazowych pomiędzy tymi stanami skupienia dla pierwszych czternastu alkanów o łańcuchach prostych przedstawia rysunek. Jak widać, temperatura wrzenia tych związków rośnie monotonicznie ze wzrostem długości łańcucha (liczby atomów węgla), natomiast temperatura topnienia rośnie monotonicznie począwszy od propanu.
Spośród alkanów i cykloalkanów o tej samej liczbie atomów węgla, temperatura wrzenia cykloalkanu jest wyższa niż odpowiedniego alkanu liniowego[7], natomiast temperatury wrzenia alkanów o łańcuchach rozgałęzionych są niższe niż alkanu liniowego[8]. Tę ostatnią regularność można wytłumaczyć zmniejszeniem powierzchni cząsteczek rozgałęzionych w stosunku do liniowych, przez co obniża się liczba oddziaływań międzycząsteczkowych, a więc ich pokonanie staje się możliwe w niższych temperaturach[8].
W temperaturze pokojowej (25 °C) alkany liniowe lżejsze od pentanu (tj. zawierające 1–4 atomów węgla) są gazami, dalsze homologi – od pentanu do heptadekanu (5–17 atomów C) są cieczami, a oktadekan i cięższe (≥18 atomów C) są ciałami stałymi[7].
Najważniejsze reakcje
[edytuj | edytuj kod]Nazwa węglowodory nasycone wynika z faktu pełnego wysycenia atomów węgla wiązaniami pojedynczymi, co odróżnia je od węglowodorów nienasyconych, posiadających wiązania podwójne i/lub potrójne.
Ze względu na dużą trwałość pojedynczych wiązań C−C i C−H alkany są mało reaktywnymi związkami chemicznymi, a reakcje z ich udziałem wymagają drastycznych warunków (wysokich temperatur i ciśnienień). Generalnie wyróżnia się trzy typy reakcji, którym ulegają alkany[9][10]:
- spalanie
- spalanie całkowite – produkty spalania to dwutlenek węgla i para wodna (woda); na przykładzie metanu:
- CH
4 + 2O
2 → CO
2 + 2H
2O
- spalanie niecałkowite – w skład spalin wchodzą także produkty utlenione częściowo, np. tlenek węgla lub sadza (węgiel)
- halogenowanie rodnikowe (substytucja) – powstają pochodne alkanów, na przykład:
- CH
4 + Cl
2 → CH
3Cl + HCl – reakcja metanu z chlorem, w wyniku której powstaje chlorometan i chlorowodór
- piroliza prowadząca do zmniejszenia długości łańcuchów węgla w cząsteczkach oraz do ich izomeryzacji. Reakcje te mają duże znaczenie praktyczne przy produkcji paliw ciekłych (kraking, reforming).
Nazewnictwo alkanów
[edytuj | edytuj kod]Nazwa alkanu składa się z trzech części:
- przedrostka i/lub wrostka – lokantu podstawnika
- rdzenia – liczby atomów węgla w łańcuchu głównym
- przyrostka „-an” (przewidzianego dla alkanów).
Etapy nazywania alkanu:
- Wyszukanie macierzystego związku.
- Znalezienie najdłuższego łańcucha atomów węgla (jeżeli dwa różne łańcuchy mają identyczną długość, wybiera się ten z największą liczbą rozgałęzień).
- Numeracja w łańcuchu głównym:
- Atomy węgla numeruje się od końca najbliższego pierwszemu rozgałęzieniu.
- Jeżeli rozgałęzienia występują w równej długości od końców, numeruje się od końca bliższego drugiemu rozgałęzieniu.
- Określenie i numeracja podstawników:
- Każdy podstawnik oznacza się zgodnie z miejscem przyłączenia do łańcucha głównego.
- Jeżeli do danego atomu węgla są przyłączone dwa podstawniki lub więcej, przypisuje się im tę samą cyfrę.
- Zapis nazwy związku
- Podstawniki podaje się w kolejności alfabetycznej, przy czym:
- przedrostek „izo-” (np. izobutyl) włączany jest do nazwy i pierwszą literą jest „i”
- pozostałe przedrostki (np. sec, tert; np. tert-butyl) i ich skróty (s, t; np. tBu) oraz lokanty liczbowe nie są włączane do nazwy, a więc np. dla tert-butyl pierwszą literą jest „b”.
- Całą nazwę zapisuje się w postaci jednego słowa, przy czym:
- do oddzielenia przedrostów i/lub wrostków używa się łącznika (-)
- do rozdzielenia lokantów używa się przecinka (,)
- Podstawniki podaje się w kolejności alfabetycznej, przy czym:
Przykład: 2,2-dimetylobutan
- „2,2” – lokanty podstawników (oba podstawniki są przy tym samym atomie węgla, dlatego oznaczone są tą samą liczbą)
- „di” – liczba podstawników danego rodzaju przy danym atomie węgla („di-”, „tri-”, „tetra-”)
- „metylo” – nazwa podstawników (tutaj są to grupy metylowe)
- „butan” – nazwa alkanu, który ma tyle samo atomów węgla, ile łańcuch główny.
| lp. | Nazwa alkanu | lp. | Nazwa alkanu | lp. | Nazwa alkanu | lp. | Nazwa alkanu |
|---|---|---|---|---|---|---|---|
| 1 | metan | 26 | heksakozan | 51 | henpentakontan | 76 | heksaheptakontan |
| 2 | etan | 27 | heptakozan | 52 | dopentakontan | 77 | heptaheptakontan |
| 3 | propan | 28 | oktakozan | 53 | tripentakontan | 78 | oktaheptakontan |
| 4 | butan | 29 | nonakozan | 54 | tetrapentakontan | 79 | nonaheptakontan |
| 5 | pentan | 30 | triakontan | 55 | pentapentakontan | 80 | oktakontan |
| 6 | heksan | 31 | hentriakontan | 56 | heksapentakontan | 81 | henoktakontan |
| 7 | heptan | 32 | dotriakontan | 57 | heptapentakontan | 82 | dooktakontan |
| 8 | oktan | 33 | tritriakontan | 58 | oktapentakontan | 83 | trioktakontan |
| 9 | nonan | 34 | tetratriakontan | 59 | nonapentakontan | 84 | tetraoktakontan |
| 10 | dekan | 35 | pentatriakontan | 60 | heksakontan | 85 | pentaoktakontan |
| 11 | undekan | 36 | heksatriakontan | 61 | henheksakontan | 86 | heksaoktakontan |
| 12 | dodekan | 37 | heptatriakontan | 62 | doheksakontan | 87 | heptaoktakontan |
| 13 | tridekan | 38 | oktatriakontan | 63 | triheksakontan | 88 | oktaoktakontan |
| 14 | tetradekan | 39 | nonatriakontan | 64 | tetraheksakontan | 89 | nonaoktakontan |
| 15 | pentadekan | 40 | tetrakontan | 65 | pentaheksakontan | 90 | nonakontan |
| 16 | heksadekan | 41 | hentetrakontan | 66 | heksaheksakontan | 91 | hennonakontan |
| 17 | heptadekan | 42 | dotetrakontan | 67 | heptaheksakontan | 92 | dononakontan |
| 18 | oktadekan | 43 | tritetrakontan | 68 | oktaheksakontan | 93 | trinonakontan |
| 19 | nonadekan | 44 | tetratetrakontan | 69 | nonaheksakontan | 94 | tetranonakontan |
| 20 | eikozan | 45 | pentatetrakontan | 70 | heptakontan | 95 | pentanonakontan |
| 21 | heneikozan | 46 | heksatetrakontan | 71 | henheptakontan | 96 | heksanonakontan |
| 22 | dokozan | 47 | heptatetrakontan | 72 | doheptakontan | 97 | heptanonakontan |
| 23 | trikozan | 48 | oktatetrakontan | 73 | triheptakontan | 98 | oktanonakontan |
| 24 | tetrakozan | 49 | nonatetrakontan | 74 | tetraheptakontan | 99 | nonanonakontan |
| 25 | pentakozan | 50 | pentakontan | 75 | pentaheptakontan | 100 | hektan |
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ parafina. Słownik wyrazów obcych PWN. [dostęp 2016-02-13]. [zarchiwizowane z tego adresu (2014-02-22)].
- ↑ Witold Doroszewski (red.): parafina. [w:] Słownik języka polskiego [on-line]. PWN. [dostęp 2016-02-13].
- ↑ a b alkanes, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.A00222, ISBN 0-9678550-9-8 (ang.).
- ↑ cycloalkanes, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.C01497, ISBN 0-9678550-9-8 (ang.).
- ↑ Robert T. Morrison, Robert N. Boyd: Chemia organiczna. T. 1. Warszawa: PWN, 1985, s. 105–110, 179–181. ISBN 83-01-04166-8.
- ↑ Number of n-node unrooted quartic trees; number of n-carbon alkanes C(n)H(2n+2) ignoring stereoisomers. The On-Line Encyclopedia of Integer Sequences. [dostęp 2010-10-04]. (ang.).
- ↑ a b Robert T. Morrison, Robert N. Boyd: Chemia organiczna. T. 1. Warszawa: PWN, 1985, s. 117, 342. ISBN 83-01-04166-8.
- ↑ a b Robert T. Morrison, Robert N. Boyd: Chemia organiczna. T. 1. Warszawa: PWN, 1985, s. 118. ISBN 83-01-04166-8.
- ↑ Robert T. Morrison, Robert N. Boyd: Chemia organiczna. T. 1. Warszawa: PWN, 1985, s. 128–146. ISBN 83-01-04166-8.
- ↑ Produkty spalania. warter.pl. [zarchiwizowane z tego adresu (2016-06-25)]. Zakłady Chemiczne Warter. Dostęp: 2016-11-06.





