Cofator de molibdénio
| Cofator de molibdénio Alerta sobre risco à saúde | |
|---|---|
| |
| Identificadores | |
| Número CAS | |
| PubChem | |
| DrugBank | DB02137 |
| SMILES |
|
| Propriedades | |
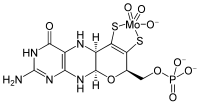
| Fórmula química | C10H12MoN5O8PS2 |
| Massa molar | 521.23 g mol-1 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
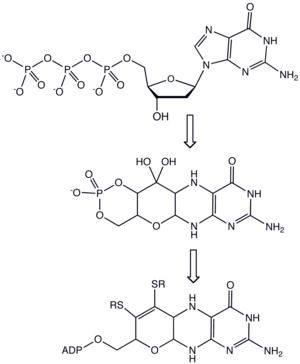
O cofator de molibdénio é um cofator necessário à atividade de enzimas como sulfito oxidase, xantina oxirredutase e aldeído oxidase.[1][2] É um composto de coordenação formado entre a molibdopterina (a qual apesar do nome não contém molibdénio) e um óxido de molibdénio.
As molibdopterinas, por seu lado, são sintetizadas a partir do trifosfato de guanosina (ver via sintética à direita).
O cofator de molibdénio funciona diretamente na etilbenzeno desidrogenase, gliceraldeído-3-fosfato ferredoxina oxirredutase e arsenato redutase.
Nos animais e plantas estas enzimas usam o molibdénio ligado ao sítio ativo por meio de um cofator de molibdénio tricíclico. Todas as enzimas que usam o molibdénio já identificadas na natureza usam este cofator, excetuando as filogeneticamente antigas nitrogenases de molibdénio, que fixam o azoto em algumas bactérias e cianobactérias.[3] As enzimas de molibdénio nas plantas e animais catalisam a oxidação e por vezes redução, de determinadas moléculas pequenas, como parte da regulação dos ciclos do azoto, enxofre e carbono.[4]
Ver também
[editar | editar código-fonte]- Deficiência do cofator de molibdénio uma doença genética
Referências
- ↑ Schwarz G (dezembro 2005). «Molybdenum cofactor biosynthesis and deficiency». Cell. Mol. Life Sci. 62 (23): 2792–810. PMID 16261263. doi:10.1007/s00018-005-5269-y
- ↑ Smolinsky B, Eichler SA, Buchmeier S, Meier JC, Schwarz G (junho 2008). «Splice-specific functions of gephyrin in molybdenum cofactor biosynthesis». J. Biol. Chem. 283 (25): 17370–9. PMID 18411266. doi:10.1074/jbc.M800985200
- ↑ [1] Structure, synthesis, empirical formula for the di-sulfhydryl. Accessed Nov. 16, 2009.
- ↑ Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U; Kroneck, P.M.H (1999). «A structural comparison of molybdenum cofactor-containing enzymes». FEMS Microbiol. Rev. 22 (5): 503. 503–521 páginas. PMID 9990727. doi:10.1111/j.1574-6976.1998.tb00384.x
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Molybdenum cofactor», especificamente desta versão.
