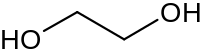
Etandiol
| Glykol | |
  | |
| Systematiskt namn | Etan-1,2-diol |
|---|---|
| Övriga namn | Etylenglykol, Dihydroxietan, Monoetylenglykol |
| Kemisk formel | C2H4(OH)2 |
| Molmassa | 62,068 g/mol |
| Utseende | Färglös och luktlös vätska, något viskös |
| CAS-nummer | 107-21-1 |
| SMILES | OCCO |
| Egenskaper | |
| Densitet | 1,1132 g/cm³ |
| Löslighet (vatten) | Blandbar |
| Smältpunkt | -13 °C |
| Kokpunkt | 198 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Etandiol, vardagligt glykol, ofta även förtydligande kallad etylenglykol, är den enklaste tvåvärda alkoholen (diolen) med formeln (OH)CH2CH2(OH). Etandiol har hög kokpunkt på grund av att ämnets molekyler binds via vätebindningar. Ämnet används bland annat i kylarvätska i bilar i syfte att sänka fryspunkten.
Tillverkning
[redigera | redigera wikitext]Etylenglykol tillverkas från eten (trivialnamn etylen) via etenoxid. Etenoxid reagerar med vatten och glykol framställs enligt nedanstående kemiska reaktionsformel.
Numera finns även återvunnen glykol tillgänglig.[1][2]
Användning
[redigera | redigera wikitext]Främst används etylenglykol som frostskydd i till exempel bilar men även i solfångare. I och med den låga fryspunkten kan den också användas till avisning för flygplan eller vindrutor.
I kylare på bilar har glykolen två funktioner, dels som frostskydd för kylsystemet, dels som rostskydd i kylsystemet. En blandning av 50 procent vatten och 50 procent glykol ger en fryspunkt på ca -40 °C samtidigt som den höjer kokpunkten till ungefär 108 °C. Övertrycket i en bils kylsystem innebär dessutom att vätskan kokar vid ungefär 120 °C. Den höjda kokpunkten medger således (tillåter) att en bil kan köras på högre temperatur och därför få effektivare förbränning.
Glykol fryser vid -13 °C[3] medan vatten fryser vid 0 °C. Det är alltså blandningen vatten–glykol som ger önskad låg fryspunkt.
Etylenglykol används även i indirekta kyl- och värmepumpsystem.[förtydliga]
Giftighet
[redigera | redigera wikitext]Intag av etandiol leder till etylenglykolförgiftning.
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- ^ Green, Mats (5 oktober 2017). [https://www.riksdagen.se/sv/dokument-lagar/dokument/motion/atervinning-av-glykol_H5023196 ”Återvinning av glykol Motion 2017/18:3196 av Mats Green (M)”]. Sveriges riksdag. https://www.riksdagen.se/sv/dokument-lagar/dokument/motion/atervinning-av-glykol_H5023196. Läst 11 februari 2019.
- ^ ”Återvunnet glykol till slutkonsument”. Forskarbladet.se. 27 mars 2017. Arkiverad från originalet den 23 augusti 2018. https://web.archive.org/web/20180823144716/http://forskarbladet.se/artiklar/atervunnet-glykol-till-slutkonsument/. Läst 1 juni 2018.
- ^ http://www.inchem.org/documents/icsc/icsc/eics0270.htm
|


