வெப்ப இயக்கவியல்
இந்தக் கட்டுரையில் மேற்கோள்கள் அல்லது உசாத்துணைகள் எதுவும் இல்லை. |
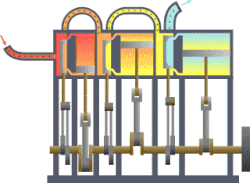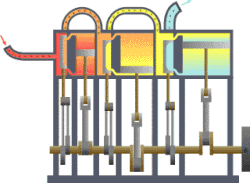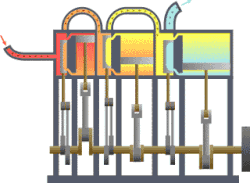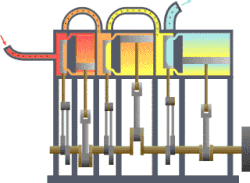
வெப்ப இயக்கவியல் (Thermodynamics) என்பது வெப்பம், அதன் தன்மை, வெப்ப ஆற்றலுக்குப் பிற ஆற்றல் வடிவங்களுடான தொடர்பு போன்ற விடயங்களை ஆயும் இயல். இயற்பியலின் ஒரு கிளைத் துறையான இது, இயற்பியல் முறைமைகளில், வெப்பநிலை, அழுத்தம், கனவளவு ஆகியவற்றில் ஏற்படும் மாற்றங்களின் விளைவுகளை ஆய்வு செய்கிறது. மேற்படி விளைவுகளைப் பெருநோக்கு (macroscopic) அடிப்படையில் துகள்களின் மொத்த இயக்கங்களையும், புள்ளியியல் முறைகளைப் பயன்படுத்தி இது ஆய்வு செய்கின்றது. அண்ணளவாக, வெப்பம் என்பது மாறுநிலையில் உள்ள ஆற்றல் ஆகும். எனவே வெப்ப இயக்கவியலின் பிழிவானது, ஆற்றலின் இயக்கம் பற்றியும், அவ்வாற்றல் எவ்வாறு இயக்கத்தை ஏற்படுத்துகிறது என்பது பற்றியும் ஆய்வு செய்தல் ஆகும். இத்துறையை தெறுமத்தினவியல் என்றும் தமிழில் குறிப்பிடலாம் எனச் சிலர் பரிந்துரை செய்கின்றனர்.
தொடக்கத்தில் இத்துறையானது நீராவி எஞ்சினின் பயனுறு திறனை (efficiency) மேம்படுத்துவதற்காகவே உருவாக்கி வளர்க்கப்பட்டது.
வெப்ப இயக்கவியல் முதல் விதி
வெப்ப இயக்கவியல் முதல் விதியின்படி ஆற்றலானது ஒரு வகையிலிருந்து மற்றொரு வகையாக மாறக்கூடியது மற்றும் எந்த ஒரு செயல்முறையிலும் ஆற்றலை ஆக்கவோ அல்லது அழிக்கவோ இயலாது. வெப்ப இயக்கவியல் முதல் விதியானது ஒவ்வொரு செயல்முறையின் போதும் நிகழும் வெவ்வேறு ஆற்றல் மாற்றங்களைப் பற்றிக் கூறுகிறது. ஆனால், அத்தகைய ஆற்றல் மாற்றங்கள் பற்றி விளக்குவதில்லை. ஒரு செயல் முறை நிகழும் திசையானது தன்னிச்சையானதா அல்லது தன்னிச்சையற்றதா என்பதைப் பற்றிய கருத்தையும் வெப்ப இயக்கவியல் முதல் விதி கூறவில்லை.
வெப்ப இயக்கவியல் இரண்டாம் விதி
கெல்வின் பிளாங்க் கூற்று
ஒரு முழுமையான சுற்றில் ஒரு பொருளிலிருந்து வெப்பத்தை உறிஞ்சி, அத்தகைய அமைப்பில் எத்தகைய சிறு மாற்றத்தையும் எற்படுத்தமால், முழுவதுமாக வேலையாக மாற்றக் கூடிய இயந்திரத்தை வடிவமைக்க இயலாது.
கிளாசியஸ் கூற்று
- ஏத்தகைய வேலையும் செய்யாமல் வெப்பத்தை குளிர்ந்த பொருளிலிருந்து சூடான பொருளுக்கு மாற்றுவது இயலாது .
- என்ட்ரோபியை அதிகரிக்கூடிய செயல்முறையானது தன்னிச்சையனதாகும்.இக்கூற்று என்ட்ரோபி கூற்று எனப்படும். என்ட்ரோபி என்பது ஒழுங்கற்ற தன்மையை குறிக்கிறது.ஒர் இயந்திரத்தின் திறன் எப்பொழுதும் 100% அடையாது.
- எந்த ஒர் இயந்திரத்தின் திறன் என்பது வெளிப்படுத்திய ஆற்றலுக்கும், உறிஞ்சப்பட்ட ஆற்றலுக்கும் உள்ள விகிதத்தின் மதிப்பாகும். எனவே 100% திறனை ஒரு பொதும் அடைய இயலாது.
என்ட்ரோபி மாற்றம்
வெப்ப இயக்கவியல் இரண்டாம் விதியால் அறிமுகப்படுத்தப்பட்ட என்ரோபி சார்பு என்பது உமிழப்படும் வெப்பத்ததிற்கும் (வ) செயல்முறையின் வெப்ப நிலைக்கும் உள்ள விகிதமாகும்.
'இயற்கை செயல்முறை' என்பது தன்னிச்சை செயல்முறையாகும் இவை தாமாகவே நடைபெறுகின்றன.அண்டத்தின் என்ட்ரோபி மாற்றமானது பூச்சியமாகவோ அல்லது எதிர்க்குறியையோ பெற்றிருக்கும் போது, அமைப்பானது தன்னிச்சையற்ற செயல்முறையில் இயங்கும்.
ஒரு வேதிவினையில், வினைவிளை பொருள்களின் மூலக்கூறுகளின் எண்ணிக்கையானது வினைபடு பொருள்களின் மூலக்கூறுகளின் எண்ணிக்கையை விட அதிகமாக இருக்கும் போது என்ட்ரோபி அதிகரிக்கிறது.
(1) ஒரு திண்மம் நீர்மமாதல் , ஒரு நீர்மம் ஆவியாதல் மற்றும் ஒரு திண்மம் ஆவியாதல் ஆகிய நிலைமை மாற்ற இயற்பியல் செயல்முறைகளின் போது என்ட்ரோபி அதிகரிக்கிறது.
என்ட்ரோபி என்பது ஓர் அமைப்பில் நிகழும் நுண்ணிய ஒழுங்கற்றத் தன்மையையும், தன்னிச்சை செயல்முறையையும் குறிக்கிறது.
டிரவுட்டன் விதி:
(1) ஹைட்ரஜன் மற்றும் ஹீலியம் போன்ற குறைந்த கொதிநிலை கொண்ட நீர்மங்கள்.இவற்றின் கொதிநிலை 0மு-ஐ விட மிகச் சிறிதளவே உயர்ந்திருக்கும். (2) நீர் மற்றும் ஆல்கஹால் போன்ற முனைவுற்ற சேர்மங்கள் ஹைட்ரஜன் பிணைப்பை கொண்டிருப்பதால் அதிகபட்ச ஆவியாதல் மதிப்பையும் பெற்றுள்ளன.
என்ட்ரோபியின் சிறப்பியல்புகள்:
(1) என்ட்ரோபி ஆனது வெப்ப இயக்கவியல் இரண்டாம் விதியிலிருந்து வெப்ப இயக்கவியல் நிலைச்சார்பாக வருவிக்கப்பட்டுள்ளது.
(2)ஒரு குறிப்பிட்ட செயல்முறையில் நிகழும் அமைப்பின் என்ட்ரோபி மாற்றம் என்பது மாறாத வெப்பநிலையில் நிகழும் வெப்ப மாற்றத்திற்கும் அமைப்பின் வெப்பநிலைக்கும் இடையேயான விகிதமாகும்.
(3) ஒரு தன்னிச்சை செயல்முறையின் போது ஒழுங்கற்றத்தன்மை அல்லது என்ரோபி அதிகரிக்கிறது. எனவே என்ரோபியானது ஒருஅமைப்பின் ஒழுங்கற்றத்தன்மை அல்லது மூலக்கூறுகளின் ஒழுங்கற்ற அமைப்பு ஆகியவற்றை அளவிடும் பண்பாகும். ஒரு மீளா செயல்முறையின்போது அண்டத்தின் என்ரோபி அதிகரிக்கிறது. (4) அண்டத்தின் ஆற்றல் மாறாமல் இருந்தாலும் ,அண்டத்தின் என்ரோபி அதிகப்பட்ச அளவை நோக்கி உயர்ந்துக் கொண்டே இருக்கிறது. (5) ஒரு தன்னிச்சை செயல்முறையில் மாறாத வெப்பநிலையில் ,நேர்குரியைப் பெற்றுள்ளது(ள,0)
ஒரு சமநிலை செயல்முறையில் ஆனது பூஜ்ஜியமாகும். ஒரு தன்னிச்சையற்ற செயல்முறையில் எதிர்க்குறியைப் பெற்றுள்ளது.
