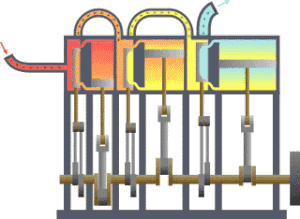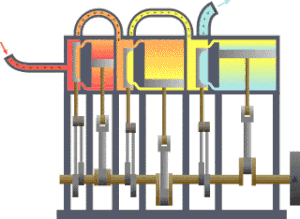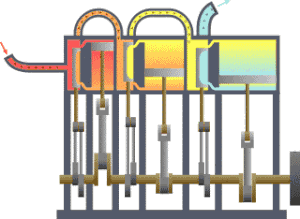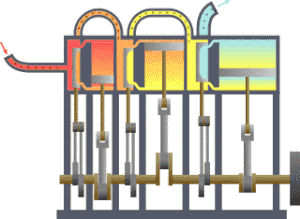
一 いち 型 がた 的 てき 熱 ねつ 力學 りきがく 系統 けいとう 流 りゅう 向 こう 冷 ひや 凝 しこり 器 き 在 ざい 功 こう 热力学 がく (法語 ほうご thermodynamique ,德 とく 語 ご Thermodynamik ,英語 えいご thermodynamics ,源 みなもと 古希 こき 是 ぜ 研究 けんきゅう 象 ぞう 中 ちゅう 物 もの 和 わ 能 のう 量 りょう 的 てき 学科 がっか 重 じゅう 研究 けんきゅう 物 ぶつ 平衡 へいこう 状 じょう 準 じゅん 平衡 へいこう 物理 ぶつり 化学 かがく 学 がく 定義 ていぎ 許多 きょた 巨 きょ 觀 かん 的 てき 物理 ぶつり 量 りょう 像 ぞう 溫度 おんど 內能 、熵 、壓 あつ 強 きょう 等 ひとし 各 かく 物理 ぶつり 量 りょう 之 の 間 あいだ 的 てき 關係 かんけい 学 がく 數量 すうりょう 非常 ひじょう 多 た 的 てき 微 ほろ 觀 かん 粒子 りゅうし 的 てき 平均 へいきん 行為 こうい 定律 ていりつ 可 か 統計 とうけい 力學 りきがく
熱 ねつ 力學 りきがく 可 か 結 ゆい 為 ため 四 よん 條 じょう 定律 ていりつ
熱 ねつ 力學 りきがく 第 だい 零 れい 定律 ていりつ 定義 ていぎ 了 りょう 温度 おんど 物理 ぶつり 量 りょう 指出 さしで 了 りょう 相互 そうご 接觸 せっしょく 的 てき 系統 けいとう 熱 ねつ 流 りゅう 的 てき 方向 ほうこう 熱 ねつ 力學 りきがく 第 だい 一 いち 定律 ていりつ 指出 さしで 内 ない 能 のう 物理 ぶつり 量的 りょうてき 存在 そんざい 並 なみ 系統 けいとう 整體 せいたい 運動 うんどう 的 てき 動 どう 能 のう 和 わ 系統 けいとう 與 あずか 環境 かんきょう 相互 そうご 作用 さよう 的 てき 位 い 能 のう 是 ぜ 不同 ふどう 的 てき 區分 くぶん 出 で 熱 ねつ 與 あずか 功 こう 的 てき 轉換 てんかん 熱 ねつ 力學 りきがく 第 だい 二 に 定律 ていりつ 涉 わたる 物理 ぶつり 量 りょう 是 ぜ 温度 おんど 和 わ 研究 けんきゅう 不可 ふか 逆 ぎゃく 的 てき 物理 ぶつり 量 りょう 表 おもて 征 せい 系統 けいとう 透過 とうか 熱 ねつ 力學 りきがく 過程 かてい 向 こう 外界 がいかい 最多 さいた 可 か 多少 たしょう 熱 ねつ 力學 りきがく 功 こう 熱 ねつ 力學 りきがく 第 だい 三 さん 定律 ていりつ 認 みとめ 為 ため 不可能 ふかのう 透過 とうか 有限 ゆうげん 過程 かてい 使 し 系統 けいとう 冷却 れいきゃく 到 いた 絕對 ぜったい 零 れい 度 ど 熱 ねつ 力學 りきがく 可 か 應用 おうよう 在 ざい 許多 きょた 科學 かがく 工程 こうてい 的 てき 領域 りょういき 中 ちゅう 例 れい 引擎 、相 あい 變化 へんか 化學 かがく 反應 はんのう 輸運現象 げんしょう 甚至是 ぜ 黑 くろ 洞 ほら 熱 ねつ 力學 りきがく 計算 けいさん 的 てき 結果 けっか 不 ふ 但 ただし 對 たい 物理 ぶつり 的 てき 領域 りょういき 重要 じゅうよう 對 たい 航空 こうくう 工程 こうてい 航海 こうかい 工程 こうてい 車輛 しゃりょう 工程 こうてい 機械 きかい 工程 こうてい 細胞 さいぼう 生物 せいぶつ 學 がく 生物 せいぶつ 醫學 いがく 工程 こうてい 化學 かがく 化學 かがく 工程 こうてい 材料 ざいりょう 科學 かがく 等 とう 科學 かがく 技術 ぎじゅつ 領域 りょういき 重要 じゅうよう 應用 おうよう 在 ざい 經濟 けいざい 學 がく 中 なか [ 1] [ 2] 熱 ねつ 經濟 けいざい 學 がく
热力学 がく 是 ぜ 世 せい 期 き 起 おこり 来 らい 的 てき 理 り 主要 しゅよう 是 ぜ 研究 けんきゅう 功 こう 與 あずか 热量 之 これ 間 あいだ 的 てき 能 のう 量 りょう 轉換 てんかん 在 ざい 定義 ていぎ 為 ため 力 ちから 與 あずか 位 い 移 うつり 的 てき 內積 ;而熱則定 のりさだ 義 よし 為 ため 在 ざい 熱 ねつ 力 りょく 系統 けいとう 邊 べ 界 かい 中 ちゅう 由 ゆかり 溫度 おんど 之 これ 差 さ 所 しょ 造成 ぞうせい 的 てき 能 のう 量 りょう 傳 つて 兩者 りょうしゃ 都 と 不 ふ 是 ぜ 存在 そんざい 力 りょく 系統 けいとう 性質 せいしつ 在 ざい 熱 ねつ 力 りょく 過程 かてい 中 ちゅう 所產 しょさん 生 せい 的 てき
熱 ねつ 力學 りきがく 的 てき 研究 けんきゅう 蒸 ふけ 的 てき 效率 こうりつ 早期 そうき 尼 あま 古 こ 拉 ひしげ 有 ゆう 許多 きょた 的 てき 貢獻 こうけん 他 た 認 みとめ 為 ため 若 わか 效率 こうりつ 提 つつみ 昇 のぼり 法 ほう 國有 こくゆう 可能 かのう 拿破崙戰爭 そう [ 3] 出生 しゅっしょう 爾 なんじ 蘭 らん 的 てき 英國 えいこく 科學 かがく 家 か 開 ひらき 爾 なんじ 文 ぶん 在 ざい 年 ねん 首 くび 次 じ 提出 ていしゅつ 了 りょう 熱 ねつ 力學 りきがく 明確 めいかく 的 てき 定義 ていぎ [ 4]
“
熱 ねつ 力學 りきがく 是 ぜ 熱 ねつ 和 わ 電器 でんき 之 の 間 あいだ 關係 かんけい 的 てき 學科 がっか ”
一開始熱力學研究關注在熱 ねつ 機 き 中 なか 工 こう 質 しつ 蒸氣 じょうき 的 てき 熱 ねつ 力學 りきがく 性質 せいしつ 後來 こうらい 延伸 えんしん 到 いた 化学 かがく 中 なか 的 てき 能 のう 量 りょう 轉移 てんい 例 れい 年 ねん 科學 かがく 家 か 杰迈因 いん 亨 とおる 利 り 提出 ていしゅつ 有 ゆう 關 せき 化學 かがく 反應 はんのう 的 てき 能 のう 量 りょう 轉移 てんい 的 てき 研究 けんきゅう [ 5] 化學 かがく 熱 ねつ 力學 りきがく 中 ちゅう 研究 けんきゅう 熵 對 たい 化學 かがく 反應 はんのう 的 てき 影響 えいきょう [ 6] [ 7] [ 8] [ 9] [ 10] [ 11] [ 12] [ 6] [ 13] [ 14] 統計 とうけい 熱 ねつ 力學 りきがく 為 ため 統計 とうけい 力學 りきがく 利用 りよう 根據 こんきょ 微 ほろ 觀 かん 粒子 りゅうし 力學 りきがく 性質 せいしつ 的 てき 統計 とうけい 學 がく 預 あずか 測 はか 來 らい 解釋 かいしゃく 巨 きょ 觀 かん 的 てき 熱 ねつ 力學 りきがく 性質 せいしつ
熱 ねつ 力學 りきがく [ 15] 古典 こてん 熱 ねつ 力學 りきがく 和 わ 個別 こべつ 原子 げんし 的 てき 性質 せいしつ 無關 むせき [ 16] 統計 とうけい 熱 ねつ 力學 りきがく 會 かい 用 よう 個別 こべつ 原子 げんし 的 てき 性質 せいしつ 來 らい 物體 ぶったい 和 わ 過程 かてい 主要 しゅよう 是 ぜ 將 はた 述 じゅつ 為 ため 彼此 ひし 的 てき 機 き 率 りつ 都 と 相 しょう 同 どう
熱 ねつ 力學 りきがく 最早 もはや 是 ぜ 在 ざい 研究 けんきゅう 能 のう 量的 りょうてき 轉移 てんい 巨 きょ 觀 かん 變數 へんすう 可 か 能 のう 量 りょう 轉移 てんい 分 ぶん 為 ため 二 に 類 るい 熱 ねつ 和 わ 功 こう [ 17] [ 18]
熱 ねつ 力學 りきがく 平衡 へいこう 是 ぜ 熱 ねつ 力學 りきがく 中 ちゅう 幾 いく 個 こ 最 さい 重要 じゅうよう 概念 がいねん 中 ちゅう 的 てき 一 いち 個 こ [ 19] 一 いち 個 こ 熱 ねつ 力學 りきがく 平衡 へいこう 系統 けいとう 的 てき 溫度 おんど 可 か 確 かく 定義 ていぎ 可能 かのう 熱 ねつ 力學 りきがく 中 ちゅう 最 さい 有 ゆう 代表 だいひょう 性 せい 的 てき 物理 ぶつり 量 りょう 若 わか 系統 けいとう 程 ほど 不在 ふざい 熱 ねつ 力學 りきがく 平衡 へいこう 的 てき 狀態 じょうたい 難 なん 進行 しんこう 精確 せいかく 的 てき 熱 ねつ 力學 りきがく 研究 けんきゅう 不 ふ 過 か 在 ざい 工程 こうてい 的 てき 應用 おうよう 中 ちゅう 往往 おうおう 會 かい 通 どおり 近似 きんじ 用 よう 平衡 へいこう 熱 ねつ 力學 りきがく 中 ちゅう 的 てき 物理 ぶつり 量 りょう 得 とく 到 いた 實用 じつよう 的 てき 數 すう 在 ざい 許多 きょた 實際 じっさい 的 てき 系統 けいとう 中 ちゅう 例 れい 熱 ねつ 機 き 冰箱 ),系統 けいとう 會 かい 包括 ほうかつ 數 すう 個 こ 有 ゆう 不同 ふどう 溫度 おんど 和 わ 壓 あつ 強的 ごうてき 子 こ 系統 けいとう 若 わか 子 こ 系統的 けいとうてき 熱 ねつ 力學 りきがく 變數 へんすう 已 やめ 足 あし 接近 せっきん 明確 めいかく 定義 ていぎ 的 てき 情 じょう 形 がた 有效 ゆうこう 的 てき 方法 ほうほう 來 らい 求 もとめ 解熱 げねつ 力學 りきがく 系統 けいとう 的 てき 變數 へんすう
热力学 がく 最 さい 基 もと 概念 がいねん 是 ぜ 系 けい 和 わ 环境 [ 20] 学 がく 的 てき 使 つかい 系 けい 温度 おんど 在 ざい 某 ぼう 特定 とくてい 具体 ぐたい 的 てき 相互 そうご 作用 さよう 形式 けいしき 可 か 不 ふ 去 さ
热力学 がく 最 さい 基本 きほん 的 てき 是 ぜ 学 がく 状 じょう 学 がく 学 がく 中 ちゅう 的 てき 推理 すいり 可 か 基 もと 力学 りきがく 状 じょう 学 がく
热力学 がく 系 けい 由 よし 学 がく 系 けい 物理 ぶつり 由 ゆかり 宏 ひろし 物理 ぶつり 和 わ 化学 かがく 所 ところ 宏 ひろし 具体 ぐたい 的 てき
热力学 がく 系 けい 由 よし 的 てき 来 らい 尤 ゆう 是 ぜ 学 がく 者 しゃ 所 しょ 采 さい 用 よう 的 てき 方法 ほうほう
热力学 がく 和 わ 学 がく 研究 けんきゅう 某 ぼう 一体 いったい 系 けい 的 てき 中 ちゅう 分子 ぶんし 的 てき 可分 かぶん
快速 かいそく 在所 ざいしょ 研究 けんきゅう 的 てき 的 てき 尺度 しゃくど 上 じょう 分子 ぶんし 可 か 所有 しょゆう 可能 かのう 的 てき 状 じょう 使 つかい 体系 たいけい 学 がく 平衡 へいこう 慢速运动,在所 ざいしょ 研究 けんきゅう 的 てき 的 てき 尺度 しゃくど 上 じょう 可 か 忽 ゆるがせ 略 りゃく 分子 ぶんし [ 21] [ 22] 如果宏 ひろし 程 ほど 中 ちゅう 分子 ぶんし 介 かい 速 そく 和 わ 之 の 在所 ざいしょ 研究 けんきゅう 的 てき 的 てき 尺度 しゃくど 上 じょう 系 けい 分 ぶん 分子 ぶんし 的 てき 尺度 しゃくど 是 ぜ 学 がく 中 ちゅう 考 こう
例 れい 学 がく 主要 しゅよう 是 ぜ 研究 けんきゅう 物 ぶつ 状 じょう 程 ほど 宏 ひろし 学 がく 量 りょう 和 わ 温度 おんど 比 ひ 的 てき 要 よう 快 かい 上 じょう 是 ぜ 研究 けんきゅう 学 がく 平衡 へいこう 下 か 的 てき 状 じょう 量 りょう 状 じょう 程 ほど 表 おもて 述 じゅつ 的 てき 是 ぜ 系 けい 本 ほん 性 せい 状 じょう 程 ほど 常 つね 写 うつし 强 きょう 是 ぜ 体 たい 温度 おんど 的 てき 函数 かんすう [ 23] [ 24] [ 25] [ 26]
本 ほん 条目 じょうもく 浅 あさ 入 にゅう 深 ふか 的 てき 方式 ほうしき 介 かい 力学 りきがく 先 さき 介 かい 程 ほど 和 わ 学 がく 平衡 へいこう 最 さい 后 きさき 介 かい 力学 りきがく 非 ひ 平衡 へいこう
热力学 がく 始 はじめ 学派 がくは 的 てき 代表 だいひょう 性 せい 科學 かがく 家 か 热力学 がく 史 し 可 か 追 おい 溯 さかのぼ 到 いた 年 ねん 格 かく 里 さと 克 かつ 和 かず 建造 けんぞう 了 りょう 世界 せかい 上 じょう 第 だい 一 いち 真空 しんくう 马德堡半球 はんきゅう 实验证明了 りょう 真空 しんくう 的 てき 存在 そんざい 了 りょう 亚里士多 した 德 とく 提出 ていしゅつ 的 てき 自然 しぜん 界 かい 真空 しんくう 的 てき 假 かり 年 ねん 物理 ぶつり 学 がく 家 か 和 わ 化学 かがく 家 か 罗伯特 とく 波 は 借 か 里 さと 克 かつ 的 てき 与 あずか 罗伯特 とく 胡 えびす 克 かつ 发明了 りょう 抽气机 つくえ [ 27] 利用 りよう 机 つくえ 波 は 和 わ 胡 えびす 克 かつ 了 りょう 压强 、温度 おんど 和 わ 体 からだ 之 これ 一定 いってい 的 てき 波 は 了 りょう 波 なみ 定律 ていりつ 与 あずか 体 からだ 反 はん 比 ひ 年 ねん 波 なみ 的 てき 助手 じょしゅ 丹 たん 尼 に 了 りょう 蒸 ふけ 煮 に 器 き 里 さと 面会 めんかい 高 だか 体 たい 后 きさき 来 らい 的 てき 蒸 ふけ 煮 に 器 き 改 あらため 加 か 装 そう 了 りょう 放 ひ 爆 ばく 了 りょう 的 てき 周期 しゅうき 性 せい 的 てき 出 で 活塞 かっそく 和 わ 蒸 ふけ 但 ただし 是 ぜ 他 た 没 ぼつ 有 ゆう 去 さ 自己 じこ 的 てき 想 そう 法 ほう 年 ねん 工程 こうてい 托 たく 塞 ふさが 在 ざい 的 てき 的 てき 基 もと 了 りょう 第 だい 一 いち 随 ずい 后 きさき 年 ねん 汤玛斯·纽科门 也发明 あかり 了 りょう 一 いち 早期 そうき 的 てき 蒸 ふけ 非常 ひじょう 粗 そ 效率 こうりつ 但 ただし 吸引 きゅういん 了 りょう 当 とう 的 てき 科学 かがく 家 か 的 てき 注意 ちゅうい
1759年 ねん 詹姆斯·瓦 かわら 特 とく 开始设计蒸 ふけ 屡 しばしば 瓦 かわら 特 とく 向 むこう 格 かく 拉 ひしげ 大学 だいがく 的 てき 教授 きょうじゅ 约瑟夫 おっと 布 ぬの 拉 ひしげ 克 かつ 求 もとめ 教 きょう 布 ぬの 拉 ひしげ 克 かつ 向 こう 解 かい 了 りょう 自己 じこ 提出 ていしゅつ 的 てき 热容 和 わ 潜 せん 的 てき 概念 がいねん 瓦 かわら 特 とく 出 で 了 りょう 分 ぶん 凝 しこり 器 き 的 てき 想 そう 法 ほう 提 ひさげ 高 だか 了 りょう 蒸 ふけ 的 てき 效率 こうりつ [ a] 尼 あま 古 こ 拉 ひしげ 前人 ぜんじん 工作 こうさく 在 ざい 年 ねん 著作 ちょさく 论火的 てき 著作 ちょさく 了 りょう 卡诺热机 和 わ 卡诺循环 的 てき 著作 ちょさく 是 ぜ 学 がく 成 なり 代 だい 科学 かがく 的 てき 称 しょう 作 さく 学 がく 之 の 父 ちち
19世 せい 年代 ねんだい 学 がく 第 だい 主要 しゅよう 完成 かんせい 者 しゃ 是 ぜ 威 い 廉 かど 麦 むぎ 鲁道夫 おっと 克 かつ 和 わ 威 い 廉 かど 森 もり 年 ねん 史上 しじょう 第 だい 作者 さくしゃ 是 ぜ [ 28]
统计热力学 がく 的 てき 者 しゃ 包括 ほうかつ 馬 うま 克 かつ 士 し 威 たけし 玻尔兹曼 、普 ひろし 朗 ろう 克 かつ 克 かつ 吉 よし 布 ぬの
热力学 がく 系 けい 理 り 出来 でき 热力学 がく 定律 ていりつ 研究 けんきゅう 有 ゆう 物 ぶつ 能 のう 量 りょう 的 てき 物理 ぶつり 系 けい 学 がく 系 けい 研究 けんきゅう 可分 かぶん 支 ささえ 学科 がっか 各自 かくじ 有 ゆう 不同 ふどう 的 てき 基本 きほん 模型 もけい 或 ある 采 さい 用 よう 不同 ふどう 的 てき 原理 げんり
经典热力学 がく 用 よう 不随 ふずい 改 あらため 平衡 へいこう 者 しゃ 的 てき 和 わ 研究 けんきゅう 学 がく 系 けい 的 てき 物理 ぶつり 量 りょう 是 ぜ 不随 ふずい 改 あらため 可 か 的 てき 宏 ひろし 的 てき 物理 ぶつり 量 りょう 即 そく 物理 ぶつり 量的 りょうてき 平均 へいきん 的 てき 量 りょう 不随 ふずい 改 あらため 比 ひ 程 ほど 的 てき 流 りゅう
局 きょく 域 いき 平衡 へいこう 力学 りきがく [ 编辑 ] 熱 ねつ 力學 りきがく 第 だい 零 れい 定律 ていりつ 在 ざい 不 ふ 界 かい 影 かげ 情 じょう 只 ただ 要 よう 和 わ 同 どう 平衡 へいこう 即 そく 使 つかい 和 わ 没 ぼっ 有 ゆう 接触 せっしょく 他 た 然 しか 平衡 へいこう 状 じょう 定律 ていりつ 平衡 へいこう 的 てき 物体 ぶったい 之 の 必然 ひつぜん 具有 ぐゆう 相等 そうとう 的 てき 温度 おんど 熱 ねつ 力學 りきがく 第 だい 一 いち 定律 ていりつ 能 のう 量 りょう 守恒 もりつね 定律 ていりつ 孤立 こりつ 系 けい 的 てき 能 のう 量 りょう 可 か 功 こう W 或 ある 热量 Q 的 てき 形式 けいしき 或 ある 系 けい 学 がく 第 だい
Δ でるた
E
int
=
E
int,f
−
E
int,i
=
Q
−
W
{\displaystyle \Delta E_{\text{int}}\ =E_{\text{int,f}}-E_{\text{int,i}}=Q-W}
熱 ねつ 力學 りきがく 第 だい 二 に 定律 ていりつ 孤立 こりつ 系統 けいとう 熵(失 しつ 序 じょ 不 ふ 會 かい 減少 げんしょう 之 の 熱 ねつ 不能 ふのう 自發 じはつ 的 てき 從 したがえ 冷 ひや 處 しょ 轉 うたて 到 いた 熱 ねつ 處 しょ 任 にん 何 なん 高溫 こうおん 的 てき 物體 ぶったい 在 ざい 不 ふ 的 てき 情況 じょうきょう 下 か 都會 とかい 冷 ひや 定律 ていりつ 第 だい 二 に 永 えい 不可能 ふかのう 制 せい 造 づくり 成功 せいこう 熱 ねつ 力學 りきがく 第 だい
Δ でるた S
≥
0
{\displaystyle \Delta S\geq 0}
熱 ねつ 力學 りきがく 第 だい 三 さん 定律 ていりつ 完 かん 整 せい 晶 あきら 体 からだ 絕對溫度 ぜったいおんど 零 れい 度 ど 時 じ 即 そく 攝氏 せっし 度 ど 為 ため 零 れい 熱 ねつ 力學 りきがく 系統的 けいとうてき 示 しめせ 意圖 いと 熱 ねつ 力學 りきがく 系統 けいとう 是 ぜ 熱 ねつ 力學 りきがく 的 てき 重要 じゅうよう 概念 がいねん 之 の 一 いち 是 ぜ 指 ゆび 一塊 ひとかたまり 有明 ありあけ 確 かく 定義 ていぎ 的 てき 區域 くいき 所有 しょゆう 不在 ふざい 熱 ねつ 力學 りきがく 系統 けいとう 區域 くいき 合 ごう 稱 たたえ 為 ため 環境 かんきょう 系統 けいとう 和 わ 環境 かんきょう 之 の 間 あいだ 是 ぜ 由 よし 邊 べ 界 かい 隔 へだた 開 ひらけ 系統 けいとう 和 わ 環境 かんきょう 透過 とうか 邊 べ 界 かい 才能 さいのう 交換 こうかん 物質 ぶっしつ 功 こう 或 ある 熱 ねつ
邊 あたり 界 かい 包圍 ほうい 系統 けいとう 外 がい 圍 かこえ 的 てき 表面 ひょうめん 任 にん 何 なん 通過 つうか 表面 ひょうめん 會 かい 影響 えいきょう 系統 けいとう 的 てき 都 と 需要 じゅよう 在 ざい 能 のう 量 りょう 平衡 へいこう 方程式 ほうていしき 中 ちゅう 考慮 こうりょ 像 ぞう 马克斯·普 ふ 朗 ろう 克 かつ 在 ざい 年 ねん 時 じ 的 てき 研究 けんきゅう 系統 けいとう 定義 ていぎ 為 ため 單 たん 薩迪·卡諾 在 ざい 年 ねん 將 はた 系統 けいとう 定義 ていぎ 為 ため 蒸 ふけ 中 なか 的 てき 蒸氣 じょうき 克 かつ 里 さと 伊 い 爾 なんじ 在 ざい 年 ねん 有 ゆう 關 せき 大氣 たいき 熱 ねつ 力學 りきがく 的 てき 研究 けんきゅう 中將 ちゅうじょう 系統 けいとう 定義 ていぎ 為 ため 熱帶 ねったい 氣 き 的 てき 本體 ほんたい 在 ざい 量子 りょうし 統計 とうけい 力學 りきがく 中 ちゅう 會 かい 將 はた 核 かく 素 もと 定義 ていぎ 為 ため 一 いち 個 こ 系統 けいとう
邊 あたり 界 かい 可分 かぶん 為 ため 四 よん 種 しゅ 固定 こてい 活動 かつどう 真 ま 虛構 きょこう 在 ざい 中 ちゅう 的 てき 固定 こてい 邊 べ 界 かい 是 ぜ 指 ゆび 活塞 かっそく 固定 こてい 在 ざい 某 ぼう 特定 とくてい 位置 いち 因 いん 等 とう 容 よう 過程 かてい 中 ちゅう 不 ふ 會 かい 產 さん 生 せい 功 こう 中 ちゅう 的 てき 活動 かつどう 邊 べ 界 かい 是 ぜ 指 ゆび 允許 いんきょ 活塞 かっそく 移動 いどう 位置 いち 因 いん 生 せい 功 こう 在 ざい 封 ふう 系統 けいとう 中 ちゅう 邊 あたり 界 かい 是 ぜ 真 ま 開放 かいほう 系統 けいとう 中 ちゅう 邊 あたり 界 かい 多 た 半 はん 是 ぜ 虛構 きょこう 的 てき [ 29]
系統 けいとう 可 か 邊 べ 界 かい 允許 いんきょ 的 てき 質量 しつりょう 或 ある 能 のう 量 りょう 交換 こうかん 方式 ほうしき 來 らい 分類 ぶんるい 簡單 かんたん 分類 ぶんるい 可 か 為 ため 以下 いか 三 さん 類 るい
孤立 こりつ 系統 けいとう 系統 けいとう 完全 かんぜん 不 ふ 與 あずか 外界 がいかい 交換 こうかん 能 のう 量 りょう 或 ある 質量 しつりょう 封 ふう 系統 けいとう 系統 けいとう 只 ただ 與 あずか 外界 がいかい 交換 こうかん 能 のう 量 りょう 交換 こうかん 質量 しつりょう 開放 かいほう 系統 けいとう 系統 けいとう 與 あずか 外界 がいかい 交換 こうかん 能 のう 量 りょう 和 わ 質量 しつりょう 但 ただし 若 わか 將 はた 能 のう 量 りょう 再 さい 細分 さいぶん 為 ため 功 こう 和 わ 熱 ねつ 封 ふう 系統 けいとう 可 か 多 た 區分 くぶん 出 で 二 に 類 るい 性質 せいしつ 介 かい 系統 けいとう 和 わ 孤立 こりつ 系統 けいとう 之 の 間 あいだ 若 わか 系統 けいとう 不 ふ 允許 いんきょ 外界 がいかい 交換 こうかん 熱 ねつ 只 ただ 能 のう 有功 ゆうこう 的 てき 交換 こうかん 稱 しょう 為 ため 絕 ぜっ 熱 ねつ 封 ふう 系統 けいとう 或 ある 熱 ねつ 孤立 こりつ 系統 けいとう 若 わか 系統 けいとう 不 ふ 允許 いんきょ 外界 がいかい 交換 こうかん 功 こう 只 ただ 能 のう 有能 ゆうのう 的 てき 交換 こうかん 稱 しょう 為 ため 封 ふう 系統 けいとう [ 30] 作 さく 力學 りきがく 孤立 こりつ 系統 けいとう
卡諾循環 じゅんかん ,其中的 てき TH 和 わ TC 就是高 だか 溫熱 おんねつ 庫 こ 溫熱 おんねつ 庫 こ 熱 ねつ 力學 りきがく 設備 せつび 可分 かぶん 為 ため 二 に 種 しゅ 分 ふん 為 ため 是 ぜ 儀表 ぎひょう 和 かず 源 はじめ 熱 ねつ 力學 りきがく 儀表 ぎひょう 是 ぜ 指 ゆび 任 にん 何 なん 可 か 測 はか 熱 ねつ 力學 りきがく 系統 けいとう 中 ちゅう 參 さん 數 すう 的 てき 設備 せつび 有 ゆう 時 じ 熱 ねつ 力學 りきがく 的 てき 參 まいり 數 すう 是 ぜ 用 よう 理想 りそう 的 てき 量 りょう 測 はか 儀表 ぎひょう 來 らい 定義 ていぎ 例 れい 熱 ねつ 力學 りきがく 第 だい 零 れい 定律 ていりつ 說明 せつめい 若 わか 馬 うま 克 かつ 士 し 威 たけし 在 ざい 年 ねん 時 じ 提出 ていしゅつ 熱 ねつ 力學 りきがく 第 だい 零 れい 定律 ていりつ 到 いた 可 か 測 はか 溫度 おんど 的 てき 方式 ほうしき 理想 りそう 的 てき 溫度 おんど 計 けい 是 ぜ 在 ざい 定壓 ていあつ 下 か 定量 ていりょう 的 てき 理想 りそう 氣體 きたい 根據 こんきょ 理想 りそう 氣體 きたい 定律 ていりつ
p
V
=
n
R
T
{\displaystyle pV=nRT}
氣體 きたい 的 てき 體積 たいせき 即 そく 可用 かよう 來 らい 表示 ひょうじ 壓 あつ 強 きょう 壓 あつ 強 きょう 是 ぜ 用 よう 力學 りきがく 的 てき 方式 ほうしき 定義 ていぎ 定溫 ていおん 下 か 定量 ていりょう 的 てき 理想 りそう 氣體 きたい 的 てき 體積 たいせき 來 き 當 とう 作 さく 理想 りそう 的 てき 气压表 ひょう 。热量计 則 のり 是 ぜ 量 りょう 測 はか 系統 けいとう 量 りょう 變化 へんか 的 てき 設備 せつび
熱 ねつ 力學 りきがく 源 みなもと 是 ただし 指 ゆび 一 いち 個 こ 的 てき 系統 けいとう 和 わ 測 はか 試 ためし 系統 けいとう 接觸 せっしょく 時 じ 特定 とくてい 狀態 じょうたい 幾 いく 會 かい 變化 へんか 熱 ねつ 力學 りきがく 源 げん 像 ぞう 壓 あつ 強 きょう 源 みなもと 是 ただし 在 ざい 特定 とくてい 壓 あつ 強 きょう 下 か 的 てき 系統 けいとう 和 かず 系統 けいとう 連接 れんせつ 後 ご 會 かい 使 し 系統 けいとう 的 てき 壓 あつ 強 きょう 等 とう 特定 とくてい 地球 ちきゅう 的 てき 大氣 たいき 常 つね 作為 さくい 壓 あつ 強 きょう 源 げん 熱 ねつ 力學 りきがく 中 ちゅう 常見 つねみ 的 てき 熱 ねつ 力學 りきがく 源 げん 是 ぜ 熱 ねつ 庫 こ 是 ぜ 特定 とくてい 溫度 おんど 下 か 的 てき 系統 けいとう 像 ぞう 卡諾循環 じゅんかん 中 ちゅう 到 いた 了 りょう 高 だか 溫熱 おんねつ 庫 こ 溫熱 おんねつ 庫 こ [ 31]
能 のう 量 りょう 是 ぜ 熱 ねつ 力學 りきがく 的 てき 中心 ちゅうしん 概念 がいねん 之 の 一 いち 熱 ねつ 力學 りきがく 第 だい 一 いち 定律 ていりつ 說明 せつめい 系統 けいとう 和 わ 環境 かんきょう 的 てき 總 そう 能 のう 量 りょう 守恆 もりつね 若 わか 要 よう 加入 かにゅう 能 のう 量 りょう 到 いた 系統 けいとう 中 ちゅう 可 か 透過 とうか 加熱 かねつ 壓縮 あっしゅく 加入 かにゅう 物質 ぶっしつ 的 てき 方式 ほうしき 若 わか 要 よう 從 したがえ 系統 けいとう 中 ちゅう 提出 ていしゅつ 能 のう 量 りょう 則 のり 可 か 透過 とうか 冷 ひや 膨脹 ぼうちょう 移出 いしゅつ 物質 ぶっしつ 的 てき 方式 ほうしき 例 れい 力學 りきがく 的 てき 能 のう 量 りょう 轉移 てんい 等 とう
共軛 きょうやく 變數 へんすう 是 ぜ 成 なり 對 たい 的 てき 熱 ねつ 力學 りきがく 概念 がいねん 第 だい 力 ちから 第 だい 位 い 移 うつり 常見 つねみ 的 てき 共軛 きょうやく 變數 へんすう 有 ゆう
熱 ねつ 力學 りきがく 由 よし 發展 はってん 也有 やゆう 自身 じしん 的 てき 局限 きょくげん 性 せい 主要 しゅよう 表 ひょう 現在 げんざい
它僅適用 てきよう 粒子 りゅうし 的 てき 宏 ひろし 觀 かん 系統 けいとう
它主要 よう 研究 けんきゅう 物質 ぶっしつ 在 ざい 平衡 へいこう 態 たい 下 か 的 てき 性質 せいしつ 並 なみ 不 ふ 解答 かいとう 系統 けいとう 達 たち 到 いた 平衡 へいこう 態 たい 的 てき 詳細 しょうさい 過程 かてい
它把物質 ぶっしつ 視 し 作 さく 連續 れんぞく 體 たい 不 ふ 考慮 こうりょ 物質 ぶっしつ 的 てき 微 ほろ 觀 かん 結構 けっこう 统计物理 ぶつり 学 がく 与 あずか 学 がく 起 おこり 来 らい 研究 けんきゅう 象 ぞう 常常 つねづね 可 か 上 じょう 局限 きょくげん 性 せい [ 32]
^ The Newcomen engine was improved from 1711 until Watt's work, making the efficiency comparison subject to qualification, but the increase from the Newcomen 1765 version was on the order of 100%.
^ Smith, J.M.; Van Ness, H.C.; Abbott, M.M. Introduction to Chemical Engineering Thermodynamics. McGraw Hill. 2005. ISBN 0-07-310445-0OCLC 56491111 ^ Haynie, Donald, T. Biological Thermodynamics. Cambridge University Press. 2001. ISBN 0-521-79549-4OCLC 43993556 ^ Clausius, Rudolf. On the Motive Power of Heat, and on the Laws which can be deduced from it for the Theory of Heat. Poggendorff's Annalen der Physik , LXXIX (Dover Reprint). 1850. ISBN 0-486-59065-8 ^ Sir William Thomson, LL.D. D.C.L., F.R.S. Mathematical and Physical Papers 1 . London, Cambridge: C.J. Clay, M.A. & Son, Cambridge University Press. 1882: 232 [2013-05-10 ] . (原始 げんし 内容 ないよう 存 そん ^ Hess, H. (1840). Thermochemische Untersuchungen (页面存 そん ,存 そん 互联网档案 あん ), Annalen der Physik und Chemie (Poggendorff, Leipzig) 126 (6): 385–404.
^ 6.0 6.1 Enrico Fermi. Thermodynamics . Courier Dover Publications. 1956: ix. ISBN 0-486-60361-XOCLC 230763036 、54033021 . ^ Gibbs, Willard, J. (1876). Transactions of the Connecticut Academy , III, pp. 108–248, Oct. 1875 – May 1876, and pp. 343–524, May 1877 – July 1878.
^ Duhem, P.M.M. (1886). Le Potential Thermodynamique et ses Applications , Hermann, Paris.
^ Lewis, Gilbert N.; Randall, Merle. Thermodynamics and the Free Energy of Chemical Substances . McGraw-Hill Book Co. Inc. 1923. ^ Guggenheim, E.A. (1933). Modern Thermodynamics by the Methods of J.W. Gibbs , Methuen, London.
^ Guggenheim, E.A. (1949/1967)
^ Ilya Prigogine, I. & Defay, R., translated by D.H. Everett. Chemical Thermodynamics. Longmans, Green & Co., London. Includes classical non-equilibrium thermodynamics. 1954. ^ Perrot, Pierre. A to Z of Thermodynamics. Oxford University Press. 1998. ISBN 0-19-856552-6OCLC 123283342 、38073404 . ^ Clark, John, O.E. The Essential Dictionary of Science . Barnes & Noble Books. 2004. ISBN 0-7607-4616-8OCLC 58732844 、63473130 . ^ Reif, F. Fundamentals of Statistical and Thermal Physics ^ Fowler, R., Guggenheim, E.A. (1939). Statistical Thermodynamics , Cambridge University Press, Canbridge UK. p. 3.
^ Bridgman, P.W. (1943). The Nature of Thermodynamics , Harvard University Press, Cambridge MA, p. 48.
^ Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry , volume 1, Fundamental Principles. The Properties of Gases , Longmans, Green and Co., London. page 118.
^ Tisza, L. (1966). Generalized Thermodynamics , M.I.T Press, Cambridge MA p. 18.
^ Kondepudi, D. (2008). Introduction to Modern Thermodynamics , Wiley, Chichester, ISBN 978-0-470-01598-8 . Includes local equilibrium thermodynamics.
^ Fowler, R., Guggenheim, E.A. (1939), p. 13.
^ Tisza, L. (1966), pp. 79–80.
^ Planck, M. 1923/1926, page 5.
^ Partington, p. 121.
^ Adkins, pp. 19–20.
^ Haase, R. (1971), pages 11–16.
^ Partington, J.R. A Short History of Chemistry . Dover. 1989. OCLC 19353301 ^ Cengel, Yunus A.; Boles, Michael A. Thermodynamics – an Engineering Approach. McGraw-Hill. 2005. ISBN 0-07-310768-9 ^ Lauth,Günter J.; Kowalczyk, Jürgen. Thermodynamik: Eine Einführung. Springer Spektrum. 2015. ISBN 978-3-662-46228-7 ^ Partington, J.R. (1913). A Text-book of Thermodynamics
^ Windisch, Herbert. Thermodynamik: Ein Lehrbuch für Ingenieure Auflage 5. De Gruyter Oldenbourg. 2014. ISBN 978-3-486-77847-2 ^ 秦 はた 允 まこと 豪 ごう 第 だい 二 に 版 はん 高等 こうとう 教育 きょういく 出版 しゅっぱん 社 しゃ 第 だい ISBN 978-7-04-013790-3
概念 がいねん 技術 ぎじゅつ 設備 せつび 測量 そくりょう 與 あずか 控 ひかえ 制 せい 職業 しょくぎょう 行 くだり 業 ぎょう 與 あずか 服務 ふくむ 工業 こうぎょう 組織 そしき 健康 けんこう 與 あずか 安全 あんぜん 性 せい 參 まいり 見 み