குரோமியம் ஐம்புளோரைடு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
குரோமியம்(V) புளோரைடு
| |
| வேறு பெயர்கள்
குரோமியம் புளோரைடு, குரோமியம்(V) புளோரைடு, ஐம்புளோரோகுரோமியம், பென்டாபுளோரிடோகுரோமியம்
| |
| இனங்காட்டிகள் | |
| 14884-42-5 | |
| ChemSpider | 4574207 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 5460742 |
| |
| பண்புகள் | |
| CrF5 | |
| வாய்ப்பாட்டு எடை | 291.71 கி/மோல் |
| தோற்றம் | சிவப்பு படிகங்கள்[1] |
| அடர்த்தி | 2.89 கி/செ.மீ3[1] |
| உருகுநிலை | 34 °C (93 °F; 307 K) |
| கொதிநிலை | 117 °C (243 °F; 390 K) |
| கட்டமைப்பு | |
| படிக அமைப்பு | செஞ்சாய்சதுரம்[1] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
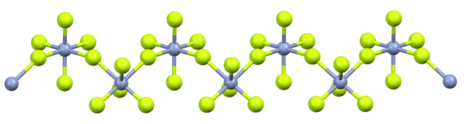
குரோமியம் ஐம்புளோரைடு (Chromium pentafluoride) என்பது CrF5 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட கனிம வேதியியல் சேர்மமாகும்[2]. குரோமியம் பெண்டாபுளோரைடு என்ற பெயராலும் இச்சேர்மம் அடையாளப்படுத்தப்படுகிறது. சிவப்பு நிறத் திண்மமான இச்சேர்மம் எளிதில் ஆவியாகக் கூடியதாகவும் 30 ° செ வெப்பநிலையில் உருகும் தன்மையும் கொண்டிருக்கிறது. எளிதாக நீராற்பகுப்பு அடைந்து குரோமியம்(III) மற்றும் குரோமியம்(VI) அயனிகளைத் தருகிறது[3] . வனேடியம் ஐம்புளோரைடின் படிக அமைப்பையே குரோமியம் ஐம்புளோரைடும் கொண்டிருக்கிறது[4]. பரவலாகக் கிடைக்கக்கூடிய குரோமியம் புளோரைடு, குரோமியம் ஐம்புளோரைடு ஆகும். கருத்தியாலான குரோமியம் அறுபுளோரைடு இதுவரை தயாரிக்கப்படவில்லை. [5]
பொட்டாசியம் மற்றும் குரோமிக் குளோரைடுகள் மீது புளோரின் வாயுவைச் செலுத்தும் போது விளைபொருளாக குரோமியம் ஐம்புளோரைடு உண்டாகிறது.[6]
அமைப்பைப் பொறுத்தவரை இச்சேர்மம் ஒருபரிமான ஒருங்கிணைப்பு பலபடியாக இருக்கிறது. ஒவ்வொரு Cr(V) மையங்களும் எண்முக மூலக்கூற்று வடிவியலைப் பெற்றுள்ளன.[7]
மேற்கோள்கள்
[தொகு]- ↑ 1.0 1.1 1.2 Perry, Dale L. (2011). Handbook of Inorganic Compounds, Second Edition. Boca Raton, Florida: CRC Press. p. 125. பன்னாட்டுத் தரப்புத்தக எண் 978-1-43981462-8. பார்க்கப்பட்ட நாள் 2014-01-10.
- ↑ Jacques Guertin, James A. Jacobs, Cynthia P. Avakian, ed. (2004). Chromium(VI) Handbook. CRC Press. p. 30. பன்னாட்டுத் தரப்புத்தக எண் 9780203487969.
{{cite book}}: CS1 maint: multiple names: editors list (link) - ↑ Amit Aora (2005). Text Book Of Inorganic Chemistry. Discovery Publishing House. p. 649.
- ↑ A. G. Sharpe (1983). Advances in Inorganic Chemistry. Vol. 27. Academic Press. p. 103. பன்னாட்டுத் தரப்புத்தக எண் 9780080578767.
- ↑ Riedel, Sebastian; Kaupp, Martin (2009). "The highest oxidation states of the transition metal elements". Coordination Chemistry Reviews 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014. http://144.206.159.178/ft/243/588116/14862785.pdf.
- ↑ A. G. Sharpe (December 2012). J.H. Simons (ed.). Fluorine Chemistry. Vol. 2. Elsevier. p. 24. பன்னாட்டுத் தரப்புத்தக எண் 9780323145435.
- ↑ "The structures of CrF5 and CrF5*SbF5" Shorafa, H.; Seppelt, K. Zeitschrift fuer Anorganische und Allgemeine Chemie 2009, vol. 635, p112-p114.
