Ентропійна діаграма
| Частина серії статей на тему: |
| Термодинаміка |
|---|
 Діаграма співвідношень температури і ентропії для водяної пари |
|
|
Ентропі́йна діагра́ма або T-s-діагра́ма (англ. temperature–entropy diagram) — діаграма стану термодинамічної системи, що використовується в термодинаміці для візуалізації зміни температури і питомої ентропії робочого тіла ході термодинамічного процесу або циклу.
Досвід вивчення теплових явищ у термодинамічних системах привів до висновку про існування потенціалу і системи координат у термічних взаємодіях. Властивості потенціалу термічної взаємодії у повні мірі має температура, перепад якої характеризує інтенсивність теплообміну між системою і навколишнім середовищем.
Однак пошук виду координати термічного стану виявився задачею досить складною у зв'язку з тим, що відповідна фізична величина не робить безпосереднього макроскопічного впливу на прилади чи органи відчуттів людини. Лише у 1854 році в результаті теоретичного аналізу проведених досліджень, Р. Клаузіус знайшов спосіб визначення величини відповідної координати, яка б характеризувала термодинамічний стан системи, що отримала назву «ентропія» (S). Так, у рівноважних процесах за наявності теплової взаємодії ентропія залишається сталою лише за відсутності теплообміну (в адіабатному рівноважному процесі dS = 0). Кількість переданої теплоти dQ в елементарному рівноважному термодинамічному процесі є пропорційною до зміни ентропії, а множником пропорційності служить потенціал термічної взаємодії — термодинамічна температура T.
Таким чином, кількість термодинамічного впливу (кількість теплоти) може бути представлена у формі:
Або для питомої кількості теплоти
Ентропія S системи виражається в Дж/К, а питома ентропія s робочого тіла — в Дж/(кг К).
Поняття ентропії як параметра стану дозволяє увести зручну для аналізу термодинамічних циклів T-s-діаграму, у якій по осі абсцис відкладається ентропія, а по осі ординат — абсолютна температура тіла. Будь-яка точка діаграми характеризує відповідний стан робочого тіла.
У довільному термодинамічному процесі температура у загальному випадку може змінюватись як у результаті теплообміну, так і під впливом обміну роботою. Тому при обчисленні повної теплоти процесу слід проінтегрувати останній вираз від початкового 1 до кінцевого 2 станів системи:
Щоб провести інтегрування, необхідно знати функціональний зв'язок температури з ентропією у вигляді рівняння процесу T = T(s).

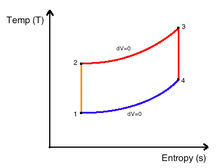
Графічне представлення цього рівняння носить назву «ентропійна (T-s) діаграма» процесу. Площа смуги, виділеної кольором на діаграмі процесу 1-2 визначається добутком Tds і тому характеризує ту малу кількість теплоти dq на елементарній ділянці процесу. Площа під кривою 1-2 (лінією процесу) характеризує теплоту процесу 1-2, тобто повну кількість теплоти, що передається між системою і навколишнім середовищем у процесі 1-2. У зв'язку з цим ентропійгу T-s-діаграму часто називають тепловою діаграмою процесу.
Перехід системи з початкового стану 1 у кінцевий 2 може відбуватись у різних термодинамічних процесах, з різними законами зміни температури у ході процесу. Це дає різні форми кривих T(s) на ентропійній діаграмі і свідчить про те, що кількість теплоти довільного процесу 1-2 не може бути обчислена за початковим 1 і кінцевим 2 станами системи, так як кількість теплоти не є функцією стану системи і залежить від характеру термодинамічного процесу.
Будь-який оборотний термодинамічний процес, що зображається у координатах v, p, може бути перенесеним у координати s, T. Для цього необхідно знати рівняння процесу f(p, v)=0, рівняння стану робочого тіла f (p, v,T)=0 і залежність s = f(p, v) ентропії від параметрів стану p і v.
Вона є корисним і поширеним інструментом, а саме: тому що це допомагає візуалізувати передачу тепла в ході процесу. Для оборотних (ідеальних) процесів, площа під кривою T-s процесу відповідає кількості тепла, що передається в систему під час процесу.
Для відшукання точки процесу на діаграмі за рівнянням стану системи і відомими значенням v і p визначають температуру T і значення ентропії s. При цьому допускається деяка умовність у виборі початку відліку ентропії, так як при розрахунках використовуються лише зміни ентропії процесів, а не її абсолютні значення. Аналогічно визначаються значення температури і ентропії для проміжних точок і отримана крива буде зображати процес в координатах s, T.
T-s-діаграма дає уявлення про кількість теплоти, підведеної/відведеної до/від робочого тіла у процесі у вигляді площі під процесом. По T-s-діаграмі також можна судити про напрям теплообміну між джерелом теплоти і робочим тілом (напрям теплового потоку повинен збігатись з алгебраїчним знаком ds, оскільки T — величина завжди додатна.
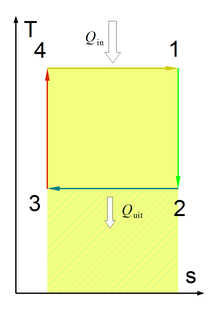
Таким чином, оборотний процес із збільшенням ентропії йде з підведенням теплоти, а оборотний процес із зменшенням ентропії йде з відведенням теплоти від робочого тіла. Будь-який оборотний термодинамічний цикл на T-s-діаграмі зображується замкнутим контуром, при чому для теплових машин-двигунів напрям обходу контуру відбувається за стрілкою годинника, а для холодильних машин — проти стрілки. Кількість теплоти, перетвореної у корисну роботу, на T-s-діаграмі зображується площею 1234.
Цикл Карно на T-s-діаграмі зображується прямокутником з двома ізотермами 4-1 і 2-3 і двома адіабатами 1-2 і 3-4. Кількість питомої теплоти, підведеної до робочого тіла у цьому циклі, визначається площею під процесом 4-1, а відведеної від процесу під процесом 2-3.
Отже, термічний ККД циклу Карно визначається відношенням:
З допомогою T-s-діаграми легко довести, що термічний ККД будь-якого оборотного циклу, здійсненого між двома джерелами теплоти, є меншим від ККД оборотного циклу Карно, що реалізується між граничними температурами цих джерел. За ступенем заповнення будь-яким циклом відповідного циклу Карно можна судити про економічні показники циклу. Чим більше оборотний цикл наближається до циклу Карно, тим більша його економічність.
- Теплотехніка: підручник для студ. вищих техн. навч. закл. / Б. Х. Драганов [та ін.]; За ред. Б. Х. Драганова. — К. : ІНКОС, 2005. — 504 с. — ISBN 966-8347-23-4
- Буляндра О. Ф. Технічна термодинаміка: Підручн. для студентів енерг. спец. вищ. навч. закладів. — К.: Техніка, 2001. — 320 с. ISBN 966-575-103-4
- Швець І. Т., Кіраковський Н. Ф. Загальна теплотехніка та теплові двигуни. — К.: Вища школа, 1977. — 269 с.
- Базаров И. П. Термодинамика. Учебник для вузов. — 4-е изд., перераб. и доп. — М.: Высшая школа — 1991. — 376 с. ISBN 5-06-000626-3
- Сивухин Д. В. Общий курс физики. Том 2. Термодинамика и молекулярная физика. — М.: Наука, 1975. — 519 c.


















