Метиламін
| Метиламін | |
|---|---|
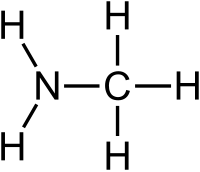
| |
| Інші назви | амінометан |
| Ідентифікатори | |
| Номер CAS | 74-89-5 |
| PubChem | 6329 |
| Номер EINECS | 200-820-0 |
| DrugBank | DB01828 |
| KEGG | C00218 |
| ChEBI | 16830 |
| RTECS | PF6300000 |
| SMILES | CN |
| InChI | InChI=1S/CH5N/c1-2/h2H2,1H3 |
| Номер Бельштейна | 741851 |
| Номер Гмеліна | 145 |
| Властивості | |
| Молекулярна формула | CH5N |
| Молярна маса | 31,06 г/моль |
| Тпл | −93.1 °C |
| Ткип | −6.0 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Метиламін — хімічна сполука з формулою CH3NH2, найпростіша органічна похідна аміаку, первинний аліфатичний амін. За нормальних умов метиламін є безбарвним газом із запахом аміаку.
Промислове виробництво метиламіну ґрунтується на взаємодії метанолу з аміаком при високій температурі (від 370 до 430 °C) та тиску приблизчно 20 атмосфер. Реакція проходить в газовій фазі на гетерогенному каталізаторі на основі цеоліту. Побічними продуктами реакції є вода, диметиламін (CH3)2NH і триметиламін (CH3)3N:[1]
Очистка метиламіну від побічних продуктів проводиться шляхом його багаторазової перегонки.
Альтернативний метод отримання метиламіну базується на взаємодії формаліну з хлористим амонієм при нагріванні.[2]
Метиламін є типовим первинним аміном. З кислотами метиламін утворює солі метиламонію. В реакціях з альдегідами й ацеталями метиламін утворює основи Шиффа. При взаємодії зі складними ефірами або ацилхлоридами дає аміди.
Горіння метиламіну проходить за рівнянням:
Метиламін використовують у синтезі пестицидів, ліків, барвників, метамфетаміну. Найбільш важливими з продуктів є N-метил-2-піролідон (NMP), метилформамід, кофеїн, ефедрин і N,N'-диметилсечовина.
В лабораторній практиці використовують у вигляді розчину 40 % мас. у воді, в метанолі, етанолі або ТГФ.
При вдиханні метиламін викликає сильне подразнення шкіри, очей та верхніх дихальних шляхів. Вдихання метиламіну призводить спочатку до збудження, а потім пригнічення центральної нервової системи. Смерть може настати від зупинки дихання.
- ↑ Corbin, David R.; Schwarz, Stephan; Sonnichsen, George C. (1997-08). Methylamines synthesis: A review. Catalysis Today (англ.). Т. 37, № 2. с. 71—102. doi:10.1016/S0920-5861(97)00003-5. Архів оригіналу за 20 червня 2019. Процитовано 5 листопада 2021.
- ↑ Organic Syntheses Procedure. www.orgsyn.org (англ.). Архів оригіналу за 5 листопада 2021. Процитовано 5 листопада 2021.
Ця стаття не містить посилань на джерела. (листопад 2016) |

|
Це незавершена стаття з хімії. Ви можете допомогти проєкту, виправивши або дописавши її. |



