Kritik nuqta (Termodinamika)

Termodinamikada kritik nuqta (yoki kritik holat) fazaviy muvozanat egri chizigʻining oxirgi nuqtasidir. Eng yorqin misol suyuqlik-bugʻning kritik nuqtasi, bosim-harorat egri chizigʻining oxirgi nuqtasi boʻlib, suyuqlik va uning bugʻi birga bir idishda boʻlishi mumkin boʻlgan sharoitlarni belgilaydi. Yuqori haroratlarda gazni faqat bosim bilan suyultirish mumkin emas. Kritik harorat Tk va kritik bosim pk bilan aniqlangan kritik nuqtada faza chegaralari yoʻqoladi. Boshqa misollarga aralashmalardagi suyuqlik-suyuqlik kritik nuqtalari va tashqi magnit maydon boʻlmaganda ferromagnit-paramagnet oʻtish kiradi.
Suyuqlik-bugʻning kritik nuqtasi
[tahrir | manbasini tahrirlash]Umumiy koʻrinish
[tahrir | manbasini tahrirlash]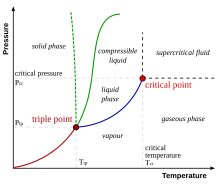
Oddiylik va ravshanlik uchun kritik nuqta haqidagi umumiy tushunchani maʼlum bir misol, bugʻ-suyuqlik kritik nuqtasini muhokama qilish orqali kiritish yaxshiroqdir. Bu kashf etilgan birinchi kritik nuqta edi va u hali ham eng mashhur va eng koʻp oʻrganilgan.
Oʻngdagi rasmda sof moddaning sxematik PT diagrammasi koʻrsatilgan (qoʻshimcha holat oʻzgaruvchilari va yanada boy faza diagrammalariga ega boʻlgan aralashmalardan farqli oʻlaroq, quyida muhokama qilinadi). Umumiy maʼlum boʻlgan qattiq, suyuq va bug' fazalari faza chegaralari, yaʼni ikki faza birga mavjud boʻlishi mumkin boʻlgan bosim-harorat birikmalari bilan ajratiladi. Uchlik nuqtada barcha uch faza birga mavjud boʻlishi mumkin. Shu bilan birga, suyuqlik-bug 'chegarasi soʻnggi nuqtada baʼzi bir kritik harorat Tk va kritik bosim pk da tugaydi. Bu kritik nuqta deyiladi.
Suvda kritik nuqta 647.096 K (373.946 °C; 705.103 °F) temperaturada va 22.064 megapascal (3,200.1 psi; 217.75 atm) bosimda sodir boʻladi[1].
Kritik nuqtaga yaqin joyda suyuqlik va bugʻning fizik xossalari keskin oʻzgaradi, ikkala faza ham oʻxshash boʻladi. Masalan, normal sharoitda suyuq suv deyarli siqilmaydi, past issiqlik kengayish koeffitsientiga ega, yuqori dielektrik oʻtkazuvchanlikka ega va elektrolitlar uchun ajoyib erituvchidir. Kritik nuqtaga yaqin joyda bu xususiyatlarning barchasi teskarisiga oʻzgaradi: suv siqiladigan, kengayadigan, yomon dielektrik, elektrolitlar uchun yomon erituvchi boʻlib, qutbsiz gazlar va organik molekulalar bilan aralashtirishni afzal koʻradi[2].
Kritik nuqtada faqat bitta faza mavjud boʻladi. Bugʻlanish issiqligi nolga teng. Bosim-hajm diagrammasida doimiy harorat chizigʻida (kritik izoterm) statsionar burilish nuqtasi mavjud. Bu shuni anglatadiki, kritik nuqtada:[3][4][5]

Kritik nuqtadan yuqorida suyuqlik va gaz holati bilan uzluksiz bogʻlangan (fazaga oʻtmasdan oʻzgarishi mumkin) materiya holati mavjud. U superkritik suyuqlik deb ataladi. Suyuqlik va bugʻ oʻrtasidagi barcha farqlar kritik nuqtadan keyin yoʻqolishi haqidagi umumiy darslik bilimi Fisher va Widom tomonidan eʼtiroz bildirildi[6], ular turli asimptotik statistik xususiyatlarga ega boʻlgan holatlarni ajratib turadigan p-T chizigʻini aniqladilar (Fisher-Widom chizigʻi).
Baʼzan kritik nuqta aksariyat termodinamik yoki mexanik xususiyatlarda namoyon boʻlmaydi, balki „yashirin“ boʻlib, elastik modullarda bir hil boʻlmaganlikning boshlanishida, affin boʻlmagan tomchilarning koʻrinishi va lokal xossalarida sezilarli oʻzgarishlar boʻlishida va toʻsatdan paydo boʻlishida namoyon boʻladi[7].
Tarix
[tahrir | manbasini tahrirlash]
Kritik nuqtaning mavjudligi birinchi marta 1822-yilda Charles Cagniard de la Tour tomonidan kashf etilgan[8][9] va 1860-yilda Dmitriy Mendeleyev[10][11] va 1869-yilda Tomas Andrews[12] nomini bergan. Cagniard CO2 ni 31° C da 73 atm bosim ostida suyultirish mumkinligini koʻrsatdi. Lekin bundan bir oz yuqoriroq haroratda, hatto 3000 atm dan yuqori bosim ostida ham suyulish jarayoni kuzatilmadi.
Nazariya
[tahrir | manbasini tahrirlash]Yuqoridagi shartni yechish orqali van der Waals tenglamasi uchun kritik nuqtani quyidagicha hisoblab topish mumkin.
Biroq, oʻrtacha maydon nazariyasiga asoslangan van der Waals tenglamasi kritik nuqtaga yaqin emas. Xususan, u notoʻgʻri oʻlchov qonunlarini bashorat qiladi.
Kritik nuqtaga yaqin suyuqliklarning xususiyatlarini tahlil qilish uchun baʼzan kritik xususiyatlarga nisbatan qisqartirilgan holat oʻzgaruvchilari aniqlanadi[13]
Tegishli holatlar prinsipi shuni koʻrsatadiki, bir xil pasaytirilgan bosim va haroratdagi moddalar teng qisqartirilgan hajmlarga ega. Bu munosabat koʻpgina moddalar uchun taxminan toʻgʻri, lekin pr ning katta qiymatlari uchun tobora noaniq boʻlib qoladi.
Baʼzi gazlar uchun Nyutonning tuzatish deb ataladigan qoʻshimcha tuzatish omili mavjud boʻlib, u shu tarzda hisoblangan kritik harorat va kritik bosimga qoʻshiladi. Bu empirik tarzda olingan qiymatlar boʻlib, qiziqish doirasiga qarab oʻzgaradi[14].
Tanlangan moddalar uchun suyuqlik-bugʻning kritik harorati va bosimi jadvali
[tahrir | manbasini tahrirlash]| Modda[15][16] | Kritik temperatura | Kritik bosim (absolyut qiymat) |
|---|---|---|
| Argon | −122.4 °C (150.8 K) | 48.1 atm (4,870 kPa) |
| Ammonia (NH3)[17] | 132.4 °C (405.5 K) | 111.3 atm (11,280 kPa) |
| R-134a | 101.06 °C (374.21 K) | 40.06 atm (4,059 kPa) |
| R-410A | 72.8 °C (345.9 K) | 47.08 atm (4,770 kPa) |
| Brom | 310.8 °C (584.0 K) | 102 atm (10,300 kPa) |
| Seziy | 1,664.85 °C (1,938.00 K) | 94 atm (9,500 kPa) |
| Xlor | 143.8 °C (416.9 K) | 76.0 atm (7,700 kPa) |
| Etan | 31.17 °C (304.32 K) | 48.077 atm (4,871.4 kPa) |
| Etanol | 241 °C (514 K) | 62.18 atm (6,300 kPa) |
| Ftor | −128.85 °C (144.30 K) | 51.5 atm (5,220 kPa) |
| Geliy | −267.96 °C (5.19 K) | 2.24 atm (227 kPa) |
| Vodorod | −239.95 °C (33.20 K) | 12.8 atm (1,300 kPa) |
| Kripton | −63.8 °C (209.3 K) | 54.3 atm (5,500 kPa) |
| Metan (CH4) | −82.3 °C (190.8 K) | 45.79 atm (4,640 kPa) |
| Neon | −228.75 °C (44.40 K) | 27.2 atm (2,760 kPa) |
| Azot | −146.9 °C (126.2 K) | 33.5 atm (3,390 kPa) |
| Kislorod | −118.6 °C (154.6 K) | 49.8 atm (5,050 kPa) |
| Uglerod dioksid (CO2) | 31.04 °C (304.19 K) | 72.8 atm (7,380 kPa) |
| Azot oksid (N2O) | 36.4 °C (309.5 K) | 71.5 atm (7,240 kPa) |
| Sulfat kislota (H2SO4) | 654 °C (927 K) | 45.4 atm (4,600 kPa) |
| Ksenon | 16.6 °C (289.8 K) | 57.6 atm (5,840 kPa) |
| Litiy | 2,950 °C (3,220 K) | 652 atm (66,100 kPa) |
| Merkuriy | 1,476.9 °C (1,750.1 K) | 1,720 atm (174,000 kPa) |
| Oltingugurt | 1,040.85 °C (1,314.00 K) | 207 atm (21,000 kPa) |
| Temir | 8,227 °C (8,500 K) | |
| Oltin | 6,977 °C (7,250 K) | 5,000 atm (510,000 kPa) |
| Alyuminiy | 7,577 °C (7,850 K) | |
| Suv (H2O)[18][19] | 373.946 °C (647.096 K) | 217.7 atm (22,060 kPa) |
Aralashmalar: suyuqlik-suyuqlik kritik nuqta
[tahrir | manbasini tahrirlash]Yana qarang
[tahrir | manbasini tahrirlash]
- Konformal maydon nazariyasi
- Kritik darajalar
- Tanqidiy hodisalar (ilgʻor maqola)
- Elementlarning muhim nuqtalari (ma'lumotlar sahifasi)
- Kyuri nuqtasi
- Joback usuli, Klincewicz usuli, Lydersen usuli (molekulyar tuzilishdan kritik harorat, bosim va hajmni baholash)
- Suyuqlik-suyuqlik kritik nuqta
- Kritik eritma harorati past
- Néel nuqtasi
- Perkolatsiya chegaralari
- Faza o'tish
- Rushbruk tengsizligi
- O'lchov o'zgarmasligi
- Oʻz-oʻzidan tashkil etilgan kritiklik
- Superkritik suyuqlik, Superkritik quritish, O'ta kritik suv oksidlanishi, O'ta kritik suyuqlikni olish
- Trikritik nuqta
Manbalar
[tahrir | manbasini tahrirlash]- ↑ Wagner, W.; Pruß, A. (June 2002). „The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use“. Journal of Physical and Chemical Reference Data. 31-jild, № 2. 398-bet. doi:10.1063/1.1461829.
- ↑ Anisimov, Sengers, Levelt Sengers (2004): Near-critical behavior of aqueous systems.
- ↑ P. Atkins and J. de Paula, Physical Chemistry, 8th ed.
- ↑ K. J. Laidler and J. H. Meiser, Physical Chemistry (Benjamin/Cummings 1982), p. 27.
- ↑ P. A. Rock, Chemical Thermodynamics (MacMillan 1969), p. 123.
- ↑ Fisher, Widom: Decay of Correlations in Linear Systems, J. Chem.
- ↑ Das, Tamoghna; Ganguly, Saswati; Sengupta, Surajit; Rao, Madan (3 June 2015). „Pre-Yield Non-Affine Fluctuations and A Hidden Critical Point in Strained Crystals“. Scientific Reports. 5-jild, № 1. 10644-bet. Bibcode:2015NatSR...510644D. doi:10.1038/srep10644. PMC 4454149. PMID 26039380.
- ↑ Charles Cagniard de la Tour (1822). „Exposé de quelques résultats obtenu par l'action combinée de la chaleur et de la compression sur certains liquides, tels que l'eau, l'alcool, l'éther sulfurique et l'essence de pétrole rectifiée“. Annales de Chimie et de Physique (fransuzcha). 21-jild. 127–132-bet.
{{cite magazine}}: Unknown parameter|trans_title=ignored (|trans-title=suggested) (yordam) - ↑ Berche, B., Henkel, M., Kenna, R (2009) Critical phenomena: 150 years since Cagniard de la Tour.
- ↑ Mendeleev called the critical point the „absolute temperature of boiling“ (ruscha: абсолютная температура кипения; nemischa: absolute Siedetemperatur ).
- ↑ Landau, Lifshitz, Theoretical Physics, Vol.
- ↑ Andrews, Thomas (1869). „The Bakerian lecture: On the continuity of the gaseous and liquid states of matter“. Philosophical Transactions of the Royal Society. 159-jild. London. 575–590-bet. doi:10.1098/rstl.1869.0021.
- ↑ Cengel, Yunus A.. Thermodynamics: an engineering approach. Boston: McGraw-Hill, 2002 — 91–93-bet. ISBN 978-0-07-121688-3.
- ↑ Maslan, Frank D.; Littman, Theodore M. (1953). „Compressibility Chart for Hydrogen and Inert Gases“. Ind. Eng. Chem. 45-jild, № 7. 1566–1568-bet. doi:10.1021/ie50523a054.
- ↑ Emsley, John. The Elements, Second, Oxford University Press, 1991. ISBN 978-0-19-855818-7.
- ↑ Cengel, Yunus A.; Boles, Michael A.. Thermodynamics: An Engineering Approach, Fourth, McGraw-Hill, 2002 — 824-bet. ISBN 978-0-07-238332-4.
- ↑ „Ammonia - NH3 - Thermodynamic Properties“. www.engineeringtoolbox.com. Qaraldi: 2017-yil 7-aprel.
- ↑ Wagner, W.; Pruß, A. (June 2002). „The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use“. Journal of Physical and Chemical Reference Data. 31-jild, № 2. 398-bet. doi:10.1063/1.1461829.
- ↑ „Critical Temperature and Pressure“. Purdue University. Qaraldi: 2006-yil 19-dekabr.
Adabiyotlar
[tahrir | manbasini tahrirlash]- „Revised Release on the IAPWS Industrial Formulation 1997 for the Thermodynamic Properties of Water and Steam“. International Association for the Properties of Water and Steam (2007-yil avgust). Qaraldi: 2009-yil 9-iyun.





