蛋白 酶
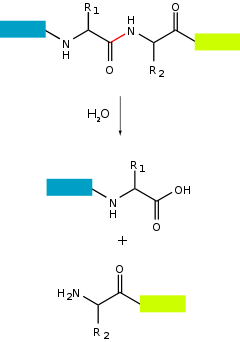

如果
分類
编辑
絲 氨酸蛋白 酶(Serine proteases) -使用 丝氨酸 醇 - 苏氨
酸 蛋白 酶(Threonine proteases)-使用 蘇 胺酸仲 醇 半 胱氨酸 蛋白 酶(Cysteine proteases) -使用 半 胱氨酸 硫醇天 冬 氨酸蛋白 酶(Aspartic acid proteases)-使用 天 冬 氨酸羧酸金屬 蛋白 酶(Metalloproteases) -使用 金属 ,通常 是 锌[3][4]谷 氨酸蛋白 酶(Glutamic acid proteases)-使用 谷 氨酸羧酸天 门冬酰胺肽裂解 酶(Asparagine peptide lyase) -使用 天 门冬酰胺進行 消 除 反應 (不 需要 水 )
1993
酶的功 能 和 機 制
编辑
催化
编辑催化
天 門 冬 胺酸、谷 氨酸和金 屬 蛋白 酶激活 水分 子 ,對 肽鍵進行 親 核 攻擊 以將其水 解 。絲 胺酸、蘇 胺酸和 半 胱氨酸 蛋白 酶使用 親 核 殘 基 (通常 在 催化三 聯 體 中 )。此殘基 進行 親 核 攻擊 ,將 蛋白 酶與底 物 蛋白 共 價 連接 ,並 釋放 產物 的 前半 部 。然 後 ,這種共 價 酰基酶中間 體 被 活 化 水 水 解 ,透過 釋放 產物 的 後半 部 並 再生 遊離 酶來完成 催化作用 。
特異 性
编辑
降 解 和 自 溶
编辑
蛋白 酶的生物 多樣 性
编辑
用途
编辑
抑制 劑
编辑
其他
参 见
编辑
参考 文献
编辑
- ^
存 档副本 . [2022-11-11]. (原始 内容 存 档于2022-05-13). - ^ López-Otín C, Bond JS. Proteases: multifunctional enzymes in life and disease. The Journal of Biological Chemistry. November 2008, 283 (45): 30433–30437. PMC 2576539 . PMID 18650443. doi:10.1074/jbc.R800035200 .
- ^ 3.0 3.1 King JV, Liang WG, Scherpelz KP, Schilling AB, Meredith SC, Tang WJ. Molecular basis of substrate recognition and degradation by human presequence protease. Structure. July 2014, 22 (7): 996–1007. PMC 4128088 . PMID 24931469. doi:10.1016/j.str.2014.05.003.
- ^ 4.0 4.1 Shen Y, Joachimiak A, Rosner MR, Tang WJ. Structures of human insulin-degrading enzyme reveal a new substrate recognition mechanism. Nature. October 2006, 443 (7113): 870–874. Bibcode:2006Natur.443..870S. PMC 3366509 . PMID 17051221. doi:10.1038/nature05143.
- ^ Radzicka A, Wolfenden R. Rates of Uncatalyzed Peptide Bond Hydrolysis in Neutral Solution and the Transition State Affinities of Proteases. Journal of the American Chemical Society. July 1996, 118 (26): 6105–6109. doi:10.1021/ja954077c.
To assess the relative proficiencies of enzymes that catalyze the hydrolysis of internal and C-terminal peptide bonds [...]
- ^ Oda K. New families of carboxyl peptidases: serine-carboxyl peptidases and glutamic peptidases. Journal of Biochemistry. January 2012, 151 (1): 13–25. PMID 22016395. doi:10.1093/jb/mvr129 .
- ^ Rawlings ND, Barrett AJ. Evolutionary families of peptidases. The Biochemical Journal. February 1993, 290 (Pt 1): 205–218. PMC 1132403 . PMID 8439290. doi:10.1042/bj2900205.
- ^ Sanman, Laura E. Activity-Based Profiling of Proteases. Annual Review of Biochemistry. June 2014, 83: 249–273. PMID 24905783. doi:10.1146/annurev-biochem-060713-035352.
- ^ Rodriguez J, Gupta N, Smith RD, Pevzner PA. Does trypsin cut before proline?. Journal of Proteome Research. January 2008, 7 (1): 300–305. PMID 18067249. doi:10.1021/pr0705035.
- ^ Renicke C, Spadaccini R, Taxis C. A tobacco etch virus protease with increased substrate tolerance at the P1' position. PLOS ONE. 2013-06-24, 8 (6): e67915. Bibcode:2013PLoSO...867915R. PMC 3691164 . PMID 23826349. doi:10.1371/journal.pone.0067915 .
- ^ Barrett AJ, Rawlings ND, Woessnerd JF. Handbook of proteolytic enzymes 2nd. London, UK: Elsevier Academic Press. 2004. ISBN 978-0-12-079610-6.
- ^ Hooper NM (编). Proteases in biology and medicine. London: Portland Press. 2002. ISBN 978-1-85578-147-4.
- ^ Feijoo-Siota L, Villa TG. Native and Biotechnologically Engineered Plant Proteases with Industrial Applications. Food and Bioprocess Technology. 28 September 2010, 4 (6): 1066–1088. S2CID 84748291. doi:10.1007/s11947-010-0431-4.
- ^ Sabotič, J; Kos, J. Microbial and fungal protease inhibitors--current and potential applications.. Applied microbiology and biotechnology. 2012-02, 93 (4): 1351–75 [2019-12-13]. PMID 22218770. doi:10.1007/s00253-011-3834-x. (
原始 内容 存 档于2020-03-15). - ^ Lee, YH; Tominaga, M; Hayashi, R; Sakamoto, K; Yamada, O; Akita, O. Aspergillus oryzae strains with a large deletion of the aflatoxin biosynthetic homologous gene cluster differentiated by chromosomal breakage.. Applied microbiology and biotechnology. 2006-09, 72 (2): 339–45 [2019-12-13]. PMID 16673111. doi:10.1007/s00253-005-0282-5. (
原始 内容 存 档于2020-03-15). - ^ te Biesebeke, R; Record, E; van Biezen, N; Heerikhuisen, M; Franken, A; Punt, PJ; van den Hondel, CA. Branching mutants of Aspergillus oryzae with improved amylase and protease production on solid substrates.. Applied microbiology and biotechnology. 2005-11, 69 (1): 44–50 [2019-12-13]. PMID 15909137. doi:10.1007/s00253-005-1968-4. (
原始 内容 存 档于2020-03-15). - ^ Machida, M; Asai, K; Sano, M; Tanaka, T; Kumagai, T; Terai, G; Kusumoto, K; Arima, T; Akita, O; Kashiwagi, Y; Abe, K; Gomi, K; Horiuchi, H; Kitamoto, K; Kobayashi, T; Takeuchi, M; Denning, DW; Galagan, JE; Nierman, WC; Yu, J; Archer, DB; Bennett, JW; Bhatnagar, D; Cleveland, TE; Fedorova, ND; Gotoh, O; Horikawa, H; Hosoyama, A; Ichinomiya, M; Igarashi, R; Iwashita, K; Juvvadi, PR; Kato, M; Kato, Y; Kin, T; Kokubun, A; Maeda, H; Maeyama, N; Maruyama, J; Nagasaki, H; Nakajima, T; Oda, K; Okada, K; Paulsen, I; Sakamoto, K; Sawano, T; Takahashi, M; Takase, K; Terabayashi, Y; Wortman, JR; Yamada, O; Yamagata, Y; Anazawa, H; Hata, Y; Koide, Y; Komori, T; Koyama, Y; Minetoki, T; Suharnan, S; Tanaka, A; Isono, K; Kuhara, S; Ogasawara, N; Kikuchi, H. Genome sequencing and analysis of Aspergillus oryzae.. Nature. 2005-12-22, 438 (7071): 1157–61 [2019-12-13]. PMID 16372010. doi:10.1038/nature04300. (
原始 内容 存 档于2020-03-15). - ^ Okuda, M; Sumitomo, N; Takimura, Y; Ogawa, A; Saeki, K; Kawai, S; Kobayashi, T; Ito, S. A new subtilisin family: nucleotide and deduced amino acid sequences of new high-molecular-mass alkaline proteases from Bacillus spp.. Extremophiles : life under extreme conditions. 2004-06, 8 (3): 229–35 [2019-12-13]. PMID 15022105. doi:10.1007/s00792-004-0381-8. (
原始 内容 存 档于2020-03-15). - ^ Puente XS, López-Otín C. A genomic analysis of rat proteases and protease inhibitors. Genome Research. April 2004, 14 (4): 609–622. PMC 383305 . PMID 15060002. doi:10.1101/gr.1946304.