维基百科,自由的百科全书
真核動物細胞中的膜囊泡運輸(Membrane vesicle trafficking)涉及到重要的生化信號分子,從高爾基體的合成和包裝位置,向分泌細胞(Secretory cells)質膜內部特定的釋放位置移動,其形式為高爾基膜結合微型囊泡(Golgi membrane-bound micro-sized vesicles),亦可被稱為膜囊泡(MVs)。在此過程中,經「包裝」的細胞產物通過其質膜釋放或分泌到細胞外。然而,該囊泡膜會被分泌細胞所保留並循環使用。這在突觸神經傳遞、內分泌腺分泌、黏液分泌、嗜中性顆粒白血球分泌顆粒狀產物等方面均起著關鍵作用。發現這個現象的科學家被授予2013年度的諾貝爾獎。
在原核革蘭氏陰性菌細胞中,膜囊泡轉運是通過細菌外膜結合的納米大小囊泡(即細菌外膜囊泡、OMV)介導的。然而在這種情況下,OMV膜也被分泌出來,同時OMV內的物質也被分泌到細菌的外部。這種現象在宿主與病原體的相互作用、患者的內毒素休克、動植物的入侵和感染、種間細菌競爭、群體感應及胞吐作用等方面起著關鍵作用。
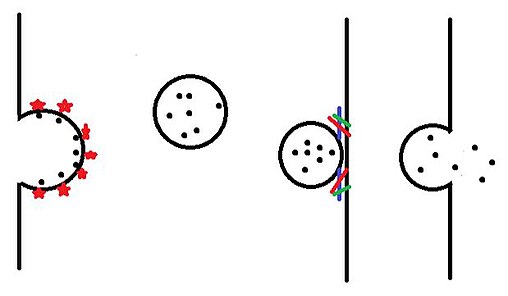 囊泡隨著貨物、受體和外被蛋白的聚集而形成。然後囊泡向外發芽並自由地進入細胞質。囊泡移向其目標位置,並且在此處停靠及進行融合。
囊泡隨著貨物、受體和外被蛋白的聚集而形成。然後囊泡向外發芽並自由地進入細胞質。囊泡移向其目標位置,並且在此處停靠及進行融合。
一旦囊泡在內質網中產生並在高爾基體中被修飾,它們便會進入細胞內的多個目的地。囊泡首先離開高爾基體,並以被稱為出芽生殖的過程釋放到細胞質中。 然後通過馬達蛋白將囊泡移向目的地。 一旦囊泡到達其目的地,它就融合過程中與雙脂層結合,然後釋放當中的內含物。
嵌入在高爾基體膜中的受體,在囊泡腔側與特定的貨物(例如多巴胺等)結合。然後,這些貨物受體募集各種蛋白質,包括其他貨物受體和外被蛋白(例如網格蛋白、COPI和COPII)。隨著越來越多的外被蛋白聚集在一起,它們使囊泡向外發芽,並且以游離的形式進入細胞質。最終將外被蛋白沉澱到細胞質中,以進行回收和再利用[1]。
細胞區室之間的運動性
[编辑]為了在細胞內不同區室之間移動,囊泡依賴着馬達蛋白的存在,即肌凝蛋白、驅動蛋白(主要是順行轉運)和動力蛋白(主要是逆行轉運)。馬達蛋白的一端附著在囊泡上,而另一端附著在微管或微絲上。然後馬達蛋白通過水解三磷酸腺苷進行移動,從而將囊泡推向目的地[2]。
當囊泡接近其預定位置時,囊泡膜中的RAB蛋白與目標位點的對接蛋白會出現相互作用。這些對接蛋白使囊泡更緊密地與靶膜中發現的SNARE蛋白複合物出現相互作用。SNARE複合物與在囊泡膜上發現的突觸小泡蛋白發生反應[3]。這將囊泡膜壓在靶複合物的膜(或細胞的外膜)上,並且使兩個膜融合。根據囊泡是與靶複合物還是與外膜融合,將囊泡中的內容物釋放到靶複合物中或細胞外部[4]。
真核生物中的例子
[编辑]- 胞內運輸發生在高爾基扁囊(Golgi cisternae)等亞細胞區室和多囊泡胞內體(multivesicular endosomes)之間,以運輸可溶解的蛋白質(如MVs)
- 當微囊泡在分泌細胞之外被釋放出來時,MVs會直接從質膜中萌芽。
- 外排體像多囊泡胞內體一樣,可以在內部腔室中形成MVs。由於多囊泡胞內體與細胞質膜的融合,最終令外排體被釋放出來。
- 通過逆轉錄病毒等病毒劫持外排體機制,病毒在多囊泡胞內體中萌芽,隨後作為外泌體被分泌出來。
以上四種在真核細胞中發生的膜囊泡運輸模式已經得到圖解說明[5]。
原核生物中的運動
[编辑]原核生物的膜囊泡運輸與真核生物的膜囊泡運輸不相同,並且是宿主-病原體界面中種內和種間信號傳導的相互作用生物學中的一個新興領域,因為原核生物細胞的細胞質缺乏內部膜區隔(membrane-compartmentalization)。超過四十年來,對革蘭氏陰性微生物的培養揭示奈米級膜囊泡的存在。自1970年代以來,就有科學家懷疑膜囊泡在致病過程中的作用。當時通過電子顯微鏡觀察到它們會在牙齦的斑塊中[6],而這些囊泡被懷疑可以促進細菌粘附到宿主上皮細胞的表面[7]。然後就有科學家證明它們在體內侵襲動物宿主細胞中的作用[8]。在細菌間的相互作用中,綠膿桿菌釋放的OMV會與其他革蘭氏陰性微生物的外膜融合,導致細菌分解,而這些OMV也可以裂解革蘭氏陽性微生物[9]。OMV作為與人胃非常相似的模型,在幽門螺桿菌感染人原發性胃竇上皮細胞中的作用也得到證實[10]。在感染了幽門螺桿菌的人胃黏膜中也可以檢測到含有VacA的OMV[11]。沙門氏菌OMV在1993年也被證明在體內對雞迴腸上皮細胞的入侵具有直接的作用。隨後進行的研究也證實它會參與病原體複製和被感染的巨噬細胞的凋亡[12]。這些研究集中於OMVs進入膜囊泡運輸,並且表明這種現象涉及多種過程,例如遺傳轉化、群體感應、微生物之間的競爭性武器(competition arsenal),以及動物宿主的入侵、感染及免疫調節等[6]。目前已經提出了一種通過革蘭氏陰性微生物產生OMV的機制[13] 。
總括來說,通過革蘭氏陰性生物的OMV,進行的膜囊泡運輸可以跨物種和跨界,包括植物界[14],進行細胞間信號傳導。
- ^ Bonifacino, JS; Glick, BS. The mechanisms of vesicle budding and fusion.. Cell. 2004-01-23, 116 (2): 153–66 [2020-03-01]. PMID 14744428. doi:10.1016/s0092-8674(03)01079-1. (原始内容存档于2020-03-01).
- ^ Hehnly, H; Stamnes, M. Regulating cytoskeleton-based vesicle motility.. FEBS letters. 2007-05-22, 581 (11): 2112–8 [2020-03-01]. PMID 17335816. doi:10.1016/j.febslet.2007.01.094. (原始内容存档于2020-03-01).
- ^ Nanavati, C; Markin, VS; Oberhauser, AF; Fernandez, JM. The exocytotic fusion pore modeled as a lipidic pore.. Biophysical journal. 1992-10, 63 (4): 1118–32 [2020-03-01]. PMID 1420930. doi:10.1016/S0006-3495(92)81679-X. (原始内容存档于2020-03-01).
- ^ Papahadjopoulos, D; Nir, S; Düzgünes, N. Molecular mechanisms of calcium-induced membrane fusion.. Journal of bioenergetics and biomembranes. 1990-04, 22 (2): 157–79 [2020-03-01]. PMID 2139437. doi:10.1007/bf00762944. (原始内容存档于2020-03-01).
- ^ Théry, C; Ostrowski, M; Segura, E. Membrane vesicles as conveyors of immune responses.. Nature reviews. Immunology. 2009-08, 9 (8): 581–93 [2020-03-01]. PMID 19498381. doi:10.1038/nri2567. (原始内容存档于2020-03-01).
- ^ 6.0 6.1 Ellis, TN; Kuehn, MJ. Virulence and immunomodulatory roles of bacterial outer membrane vesicles.. Microbiology and molecular biology reviews : MMBR. 2010-03, 74 (1): 81–94 [2020-03-01]. PMID 20197500. doi:10.1128/MMBR.00031-09. (原始内容存档于2020-03-01).
- ^ Halhoul, N; Colvin, JR. The ultrastructure of bacterial plaque attached to the gingiva of man.. Archives of oral biology. 1975-02, 20 (2): 115–8 [2020-03-01]. PMID 1054578. doi:10.1016/0003-9969(75)90164-8. (原始内容存档于2020-03-01).
- ^ YashRoy RC. Electron microscope studies of surface pili and vesicles of Salmonella 3,10:r:- organisms. Indian Journal of Animal Sciences. 1993, 63 (2): 99–102.
- ^ Kadurugamuwa, JL; Beveridge, TJ. Bacteriolytic effect of membrane vesicles from Pseudomonas aeruginosa on other bacteria including pathogens: conceptually new antibiotics.. Journal of bacteriology. 1996-05, 178 (10): 2767–74 [2020-03-01]. PMID 8631663. doi:10.1128/jb.178.10.2767-2774.1996. (原始内容存档于2020-03-01).
- ^ Heczko, U; Smith, VC; Mark Meloche, R; Buchan, AM; Finlay, BB. Characteristics of Helicobacter pylori attachment to human primary antral epithelial cells.. Microbes and infection. 2000-11, 2 (14): 1669–76 [2020-03-01]. PMID 11137040. doi:10.1016/s1286-4579(00)01322-8. (原始内容存档于2020-03-01).
- ^ Fiocca, R; Necchi, V; Sommi, P; Ricci, V; Telford, J; Cover, TL; Solcia, E. Release of Helicobacter pylori vacuolating cytotoxin by both a specific secretion pathway and budding of outer membrane vesicles. Uptake of released toxin and vesicles by gastric epithelium.. The Journal of pathology. 1999-06, 188 (2): 220–6 [2020-03-01]. PMID 10398168. doi:10.1002/(SICI)1096-9896(199906)188:2<220::AID-PATH307>3.0.CO;2-C. (原始内容存档于2020-03-01).
- ^ Yashroy RC. Hijacking of macrophages by Salmonella (3,10:r:-) through 'type-III' secretion-like exocytotic signaling: a mechanism for infection of chicken ileum.. Indian Journal of Poultry Science. 2000, 35 (3): 276–281.
- ^ YashRoy RC. Eucaryotic cell intoxication by gram-negative pathogens: a novel bacterial outermembrane-bound nanovesicular exocytosis model for type-III secretion system.. Toxicology International. June 2003, 10 (1): 1–9.
- ^ Bahar, O; Pruitt, R; Luu, DD; Schwessinger, B; Daudi, A; Liu, F; Ruan, R; Fontaine-Bodin, L; Koebnik, R; Ronald, P. The Xanthomonas Ax21 protein is processed by the general secretory system and is secreted in association with outer membrane vesicles.. PeerJ. 2014, 2: e242 [2020-03-01]. PMID 24482761. doi:10.7717/peerj.242. (原始内容存档于2020-03-01).

