碳 原子 げんし 的 てき 路 ろ 易 えき 結構 けっこう 四 よん 個 こ 價 あたい 電子 でんし 水 みず 的 まと 路 ろ 易 えき 結構 けっこう 路 みち 易 えき 結構 けっこう 英語 えいご Lewis structures 又 また 稱 たたえ 路 みち 易 えき 圖像 ずぞう 電子 でんし 點 てん 圖像 ずぞう 路 みち 易 えき 電子 でんし 點 てん 式 しき 路 みち 易 えき 結構 けっこう 電子 でんし 點 てん 結構 けっこう 是 ぜ 分子 ぶんし 中 なか 原子 げんし 和 かず 原子 げんし 鍵 かぎ 結 ゆい 和 わ 標示 ひょうじ 孤 こ 對 たい 電子 でんし 存在 そんざい 的 てき 圖像 ずぞう [ 1] [ 2] [ 3] 路 みち 易 えき 結構 けっこう 可 か 出 で 表示 ひょうじ 分 ぶん 子中 こなか 的 てき 共 きょう 價 あたい 鍵 かぎ 配 はい 位 い 化合 かごう 物 ぶつ
路 みち 易 えき 結構 けっこう 是 ぜ 国 こく 物理 ぶつり 化学 かがく 家 いえ 吉 よし 特 とく 路 ろ 易 えき 的 てき 名字 みょうじ 命名 めいめい 他 た 在 ざい 年 ねん 時 じ 把 わ 路 ろ 易 えき 入 にゅう 一 いち 篇 へん 名 めい 為 ため 原子 はらこ 和 かず 分子 ぶんし 的 てき 文章 ぶんしょう 中 ちゅう [ 4] 他 た 類似 るいじ 電子 でんし 點 てん 圖像 ずぞう 在 ざい 價 あたい 電子 でんし 和 わ 孤 こ 對 たい 電子 でんし 中 ちゅう 來 らい 表示 ひょうじ 但 ただし 線 せん 來 らい 表示 ひょうじ 共 ども 享 とおる 電子 でんし 鍵 かぎ 雙 そう 鍵 かぎ 三 さん 鍵 かぎ 等 とう
路 みち 易 えき 每 ごと 個 こ 原子 げんし 他 た 位置 いち 在 ざい 分子 ぶんし 的 てき 結構 けっこう 上 うえ 用 よう 不同 ふどう 的 てき 化學 かがく 記號 きごう 標示 ひょうじ 線畫 せんが 在 ざい 原子 げんし 和 わ 原子 げんし 間 あいだ 的 てき 鍵 かぎ 結 ゆい 一 いち 對 たい 點 てん 來 らい 表示 ひょうじ 多 た 餘 あまり 的 てき 電子 でんし 第 だい 二 に 週 しゅう 期 き 的 てき 主 あるじ 族 ぞく 元素 げんそ 可 か 反應 はんのう 獲得 かくとく 或 ある 失 しつ 去 さ 共 きょう 享 とおる 電子 でんし 讓 ゆずる 外層 がいそう 價 か 電子 でんし 填 はま 滿 まん 至 いたり 個 こ 然 しか 他 た 元素 げんそ 對 たい 電子 でんし 不同 ふどう 的 てき 規則 きそく 子 こ 的 てき 方式 ほうしき 是 ぜ 是 ぜ 填 はま 滿 まん 最 さい 外層 がいそう 的 てき 但 ただし 過渡 かと 金屬 きんぞく [ 5] 規則 きそく 例 れい 過 か 鹽 しお 離 はなれ 子 こ
路 みち 易 えき 的 てき 電子 でんし 總數 そうすう 等 とう 個 こ 原子 げんし 價 あたい 電子 でんし 的 てき 總數 そうすう 非 ひ 價 あたい 電子 でんし 不 ふ 會 かい 出現 しゅつげん 在 ざい 路 みち 易 えき 結構 けっこう 中 ちゅう
一旦 いったん 電子 でんし 的 てき 總數 そうすう 被 ひ 決定 けってい 電子 でんし 必須 ひっす 排 はい 進 しん 結構 けっこう 中 ちゅう 孤 こ 對 たい 電子 でんし 原子 げんし 除外 じょがい 直 ちょく 到 いた 外層 がいそう 被 ひ 鍵 かぎ 結 ゆい 或 ある 孤 こ 對 たい 電子 でんし 填 はま 滿 まん 八 はち 多 た 出來 でき 的 てき 孤 こ 對 たい 電子 でんし 要 よう 排 はい 在 ざい 中心 ちゅうしん 原子 げんし 當 とう 不 ふ 確定 かくてい 時 じ 孤 こ 對 たい 電子 でんし 要 よう 先 さき 排 はい 在 ざい 電 でん 負 まけ 度 ど 高 だか 的 てき 原子 げんし
一旦孤對電子排進原子,尤 ゆう 中心 ちゅうしん 原子 げんし 可能 かのう 不 ふ 會 かい 外層 がいそう 有 ゆう 八 はち 子 こ 在 ざい 況 きょう 下 か 原子 げんし 必須 ひっす 組成 そせい 共 ども 價 か 鍵 かぎ 孤 こ 對 たい 電子 でんし 的 てき 移動 いどう 形成 けいせい 第 だい 當 とう 原子 げんし 共 ども 享 とおる 電子 でんし 對 たい 時 じ 符合 ふごう 八 はち 隅 すみ 體 たい 規則 きそく
路 みち 易 えき 結構 けっこう 對 たい 原子 げんし 離 はなれ 子 こ 的 てき 畫 が 法 ほう 一 いち 樣 よう 數 かず 電子 でんし 時 じ 陰 かげ 離 はなれ 子 こ 需要 じゅよう 多 た 畫 が 電子 でんし 在 ざい 結構 けっこう 中 ちゅう 陽 ひ 離 はなれ 子 こ 則 そく 中性 ちゅうせい 狀態 じょうたい 時 じ 少 しょう 畫 が 電子 でんし
畫 が 路 ろ 易 えき 結構 けっこう 時 じ 有 ゆう 結構 けっこう 需要 じゅよう 用 よう 括 くく 號 ごう 標示 ひょうじ 若 わか 有 ゆう 電荷 でんか 則 そく 要 よう 畫 が 在 ざい 括 くく 號 ごう 的 てき 右 みぎ 上方 かみがた
這裡有 ゆう 先 さき 畫 が 原子 げんし 和 わ 電子 でんし 配 はい 對 たい 電子 でんし 形成 けいせい 鍵 かぎ 結 ゆい 陰 かげ 離 はなれ 子 こ 或 ある 陽 ひ 離 はなれ 子 こ 則 そく 增加 ぞうか 或 ある 去 さ 電子 でんし [ 6]
數 すう 價 か 電子 でんし 的 てき 小 しょう 方法 ほうほう 數 すう 需要 じゅよう 多少 たしょう 價 か 電子 でんし 能 のう 填 はま 滿 まん 符合 ふごう 八 はち 隅 すみ 體 たい 規則 きそく 子 こ 只 ただ 有 ゆう 兩 りょう 電子 でんし 然 しか 後 ご 把 わ 兩個 りゃんこ 原子 げんし 算出 さんしゅつ 的 てき 答案 とうあん 相 しょう 減 げん 形成 けいせい 鍵 かぎ 結 ゆい 的 てき 電子 でんし 數 すう 剩 あま 下 した 的 てき 電子 でんし 必須 ひっす 去 さ 填 はま 滿 まん 原子 げんし 使 つかい 之 の 符合 ふごう 八 はち 隅 すみ 體 たい 規則 きそく
其他一般 いっぱん 和 わ 簡單 かんたん 的 てき 步 ふ 畫 が 路 ろ 易 えき 共振 きょうしん 結構 けっこう 已 やめ 經 けい 被 ひ 提出 ていしゅつ 來 らい 了 りょう [ 7]
在 ざい 步 ふ 開始 かいし 前 ぜん 必須 ひっす 先 さき 了解 りょうかい 分子 ぶんし 的 てき 幾何 きか 結構 けっこう 是 ぜ 不 ふ 論 ろん 不 ふ 是 ぜ 環狀 かんじょう 結構 けっこう 每 まい 個 こ 原子 げんし 彼此 ひし 連接 れんせつ 畫 が 出 で 簡單 かんたん 或 ある 複雜 ふくざつ 的 てき 路 ろ 易 えき 結構 けっこう 方法 ほうほう 可 か 網 もう [ 8]
在 ざい 形式 けいしき 電荷 でんか 當 とう 中 ちゅう 對照 たいしょう 和 わ 評定 ひょうじょう 相似 そうじ 的 てき 共振 きょうしん 結構 けっこう [ 9] 是 ぜ 他 た 原子 げんし 的 てき 電荷 でんか 量 りょう 路 みち 易 えき 結構 けっこう 中 ちゅう 電子 でんし 數量 すうりょう 假設 かせつ 沒 ぼつ 有 ゆう 共 ども 價 か 鍵 かぎ 或 ある 非 ひ 極性 きょくせい 共 ども 價 か 鍵 かぎ 在 ざい 電子 でんし 可能 かのう 重 おも 新 しん 配置 はいち 要 よう 了解 りょうかい 反應 はんのう 機轉 きてん 的 てき 時候 じこう 不 ふ 過 か 常常 つねづね 有 ゆう partial charge 相 あい 同 どう 的 てき 時候 じこう 例外 れいがい 簡單 かんたん 來 き 講 こう 形式 けいしき 電荷 でんか 有 ゆう 公式 こうしき 以下 いか 是 ぜ 假設 かせつ
C
f
=
N
v
−
U
e
−
B
n
2
{\displaystyle C_{f}=N_{v}-U_{e}-{\frac {B_{n}}{2}}}
說明 せつめい
C
f
{\displaystyle C_{f}}
是 ぜ 形式 けいしき 電荷 でんか
N
v
{\displaystyle N_{v}}
代表 だいひょう 原子 げんし 價 か 電子 でんし 的 てき 數量 すうりょう
U
e
{\displaystyle U_{e}}
代表 だいひょう 未 み 共 とも 享 とおる 的 てき 電子 でんし 數量 すうりょう
B
n
{\displaystyle B_{n}}
代表 だいひょう 原子 げんし 間 あいだ 總 そう 鍵 かぎ 結 ゆい 數量 すうりょう 形式 けいしき 電荷 でんか 是 ぜ 計算 けいさん 路 ろ 易 えき 結構 けっこう 中 ちゅう 中性 ちゅうせい 電荷 でんか 的 てき 原子 げんし 電子 でんし 數 すう 的 てき 差異 さい 電子 でんし 在 ざい 原子 げんし 共 ども 價 か 鍵 かぎ 當 とう 中 ちゅう 是 ぜ 同等 どうとう 的 てき 被 ひ 分 ぶん 開 ひらき 離 はなれ 子 こ 的 てき 形式 けいしき 電荷 でんか 總數 そうすう 須要 しゅよう 和 わ 價 か 數 すう 相等 そうとう 還 かえ 有 ゆう 中性 ちゅうせい 分子 ぶんし 的 てき 形式 けいしき 電荷 でんか 必須 ひっす 為 ため 零 れい
主 しゅ 條目 じょうもく 共振 きょうしん 化学 かがく
有 ゆう 子 こ 或 ある 離 はなれ 子 こ 決定 けってい 對 たい 電子 でんし 是 ぜ 否 いや 要 よう 形成 けいせい 雙 そう 鍵 かぎ 或 ある 三 さん 鍵 かぎ 狀況 じょうきょう 有 ゆう 時 じ 發生 はっせい 在 ざい 相 しょう 同型 どうけい 態 たい 原子 げんし 圍繞 いじょう 中心 ちゅうしん 原子 げんし 常 つね 看 み 到 いた 發生 はっせい 在 ざい 多 た 原子 げんし 離 はなれ 子 こ
當 とう 情況 じょうきょう 發生 はっせい 易 えき 共振 きょうしん 結構 けっこう 結構 けっこう 的 てき 情況 じょうきょう 有 ゆう 重複 じゅうふく 的 てき 分子 ぶんし 的 てき 路 ろ 易 えき 結構 けっこう 是 ぜ 種 しゅ 結構 けっこう 的 てき 平均 へいきん 狀態 じょうたい
例 れい 硝酸 しょうさん 離 はなれ 子 こ 3 − )大 だい 部分 ぶぶん 都 と 是 ぜ 雙 そう 鍵 かぎ 在 ざい 子中 こなか 間 あいだ 來 らい 滿足 まんぞく 原子 げんし 的 てき 八 はち 隅 すみ 體 たい 規則 きそく 但 ただし 由 よし 結構 けっこう 不 ふ 對稱 たいしょう 所以 ゆえん 不 ふ 有 ゆう 三 さん 種 しゅ 可能 かのう 的 てき 共振 きょうしん 結構 けっこう 用 よう 路 ろ 易 えき 表示 ひょうじ 共振 きょうしん 的 てき 方式 ほうしき 為 ため 畫 が 出 で 可能 かのう 共振 きょうしん 結構 けっこう 雙 そう 鍵 かぎ 轉換 てんかん 的 てき 方向 ほうこう 用 よう 箭 や 頭 あたま 表示 ひょうじ
當 とう 比較 ひかく 完 かん 相 しょう 同 どう 分子 ぶんし 的 てき 共振 きょうしん 結構 けっこう 後 ご 常常 つねづね 擁 よう 有 ゆう 最少 さいしょう 形式 けいしき 電荷 でんか 的 てき 會 かい 貢獻 こうけん 形式 けいしき 電荷 でんか 到 いた 整 せい 個 こ 共振 きょうしん 化合 かごう 物 ぶつ 當 とう 形式 けいしき 電荷 でんか 對 たい 共振 きょうしん 結構 けっこう 重要 じゅうよう 時 じ 電荷 でんか 會 かい 喜 き 電 でん 負 まけ 度 ど 高 だか 的 てき 原子 げんし 上 じょう 電荷 でんか 會 かい 喜 き 電 でん 負 まけ 度 ど 低 てい 的 てき 原子 げんし 上 じょう
像 ぞう 六 ろく 超 ちょう 價 あたい 分子 ぶんし 鍵 かぎ 移動 いどう 他 た 的 てき 解釋 かいしゃく 是 ぜ 基 もと 量子 りょうし 化學 かがく 是 ぜ 一般 いっぱん 的 てき 擴大 かくだい 八 はち 隅 すみ 體 たい 模型 もけい
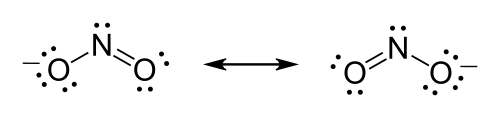
亞 あ 硝酸 しょうさん 根 ね 的 てき 化學 かがく 式 しき 是 ぜ 2 −
氮原子 げんし 是 ぜ 電 でん 負 まけ 度 ど 最低 さいてい 的 てき 原子 げんし 所以 ゆえん 為 ため 中心 ちゅうしん 原子 げんし
數 すう 數 すう 看 み 他 た 價 か 電子 でんし 原子 げんし 有 ゆう 個 こ 價 か 電子 でんし 兩個 りゃんこ 個 こ 價 か 電子 でんし 價 か 電子 でんし 總數 そうすう 是 ぜ 子 こ 帶 たい 價 か 表示 ひょうじ 有 ゆう 多 た 餘 あまり 的 てき 電子 でんし 所以 ゆえん 電子 でんし 總數 そうすう 是 ぜ 排 はい 進 しん 孤 こ 對 たい 電子 でんし 每 まい 個 こ 子 こ 必須 ひっす 和 わ 原子 げんし 鍵 かぎ 結 ゆい 是 ぜ 四 よん 個 こ 電子 でんし 兩個 りゃんこ 為 ため 一 いち 鍵 かぎ 結 ゆい 剩 あま 下 した 的 てき 個 こ 電子 でんし 先 さき 當 とう 他 た 孤 こ 對 たい 電子 でんし 讓 ゆずる 每 まい 個 こ 原子 げんし 加 か 上 じょう 鍵 かぎ 結 ゆい 總 そう 共有 きょうゆう 八 はち 子 こ 剩 あま 下 した 的 てき 孤 こ 對 たい 電子 でんし 進 しん 子中 こなか 要 よう 滿足 まんぞく 八 はち 隅 すみ 體 たい 規則 きそく 所有 しょゆう 的 てき 原子 げんし 目前 もくぜん 被 ひ 分配 ぶんぱい 到 いた 子 こ 子 こ 只 ただ 被 ひ 分配 ぶんぱい 到 いた 需要 じゅよう 所以 ゆえん 但 ただし 的 てき 原子 げんし 有 ゆう 相 しょう 同 どう 的 てき 情況 じょうきょう 所以 ゆえん 必須 ひっす 要 よう 有 ゆう 共振 きょうしん 結構 けっこう 總 そう 結 ゆい 兩個 りゃんこ 路 ろ 易 えき 結構 けっこう 必須 ひっす 都 と 畫 が 每 まい 第 だい 每 まい 個 こ 結構 けっこう 都 と 要 かなめ 畫 が 上 じょう 括 くく 號 ごう 括 くく 號 ごう 的 てき 右 みぎ 上方 かみがた 附 ふ 上 じょう 在 ざい 兩個 りゃんこ 共振 きょうしん 結構 けっこう 中 ちゅう 間 あいだ 畫 が 上 じょう 雙頭 そうとう 箭 や 號 ごう 表示 ひょうじ 之 の 兩 りょう 種 たね 丁 ちょう 的 てき 結構 けっこう 式 しき 丁 ちょう 的 てき 骨 ほね 架 か 圖像 ずぞう 丁 ちょう 空間 くうかん 填 はま 充 たかし 圖像 ずぞう 化學 かがく 的 てき 結構 けっこう 可 か 書寫 しょしゃ 得 どく 更 さら 簡單 かんたん 特別 とくべつ 是 ぜ 在 ざい 表示 ひょうじ 有機 ゆうき 化合 かごう 物 ぶつ 時 とき 結構 けっこう 式 しき 幾 いく 所有 しょゆう 的 てき 共 とも 價 か 鍵 かぎ 會 かい 被 ひ 移 うつり 除 じょ 用 よう 相 しょう 同 どう 基 もと 團 だん 寫 うつし 在 ざい
另一 いち 個 こ 的 てき 結構 けっこう 是 これ 骨 ほね 架 か 結構 けっこう 式 しき 結 ゆい 用 よう 線 せん 表示 ひょうじ 不 ふ 會 かい 標示 ひょうじ 出來 でき 用 よう 轉 うたて 折 おり 點 てん 表示 ひょうじ 原子 げんし 與 あずか 結 ゆい 則 そく 不 ふ 會 かい 表示 ひょうじ 出來 でき 原子 げんし 可 か 有 ゆう 幾 いく 個 こ 算出 さんしゅつ 數 すう 目 もく 表示 ひょうじ 只 ただ 顯示 けんじ 間 あいだ 的 てき 鍵 かぎ 結 ゆい 沒 ぼつ 有 ゆう 顯示 けんじ 間 あいだ 的 てき 鍵 かぎ 結 ゆい
有 ゆう 路 ろ 易 えき 結構 けっこう 過 か 複雜 ふくざつ 故 こ 使用 しよう 結構 けっこう 表示 ひょうじ 空間 くうかん 填 はま 充 たかし 圖像 ずぞう
^ IUPAC definition of Lewis formula . [2013-07-09 ] . (原始 げんし 内容 ないよう 存 そん ^ Zumdahl, S. (2005) Chemical Principles Houghton-Mifflin (ISBN 0-618-37206-7 )
^ G.L. Miessler, D.A. Tar, Inorganic Chemistry 2nd, Pearson Prentice–Hall, 2003, ISBN 0-130-35471-6 ^ Lewis, G. N., The Atom and the Molecule, J. Am. Chem. Soc., 1916, 38 : 762–85, doi:10.1021/ja02261a002 ^ Weinhold, Frank; Landis, Clark R. Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective. Cambridge: Cambridge University Press. 2005: 381–383. ISBN 0-521-83128-8 ^ Miburo, Barnabe B., Simplified Lewis Structure Drawing for Non-science Majors, J. Chem. Educ. , 1993, 75 (3): 317, doi:10.1021/ed075p317 ^ Lever, A. B. P., Lewis Structures and the Octet Rule, J. Chem. Educ. , 1972, 49 (12): 819, doi:10.1021/ed049p819 ^ Chemistry Net Link (页面存 そん ,存 そん 互联网档案 あん )^ Miessler, G. L., Tar, D. A., (2003), p. 53 – Explanation of formal charge usage.