Nitroësuur
|
Algemeen | |
|---|---|
| Naam | Nitroësuur |
| Sistematiese naam | Hidroksidooksidostikstof |
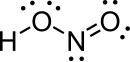 |
 |
| Chemiese formule | HNO2 |
| Molêre massa | 47,013 g•mol-1 |
| CAS-nommer | 7782-77-6 |
| Voorkoms | Ligblou oplossing |
| Fasegedrag | |
| Smeltpunt | Slegs bekend in oplossing of as gas |
| Kookpunt | |
| Digtheid | 1 g•ml-1 |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | 3,15 |
|
Veiligheid | |
| Flitspunt | nie flambaar |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
- Moet nie met salpetersuur (HNO3) verwar word nie
Nitroësuur (word soms salpeterigsuur genoem, molekulêre formule HNO2) is 'n swak en monoprotiese suur wat slegs in oplossing, in die gasfase en in die vorm van nitrietsoute (NO−2) bekend is.[1] Nitroësuur word gebruik om diasoniumsoute van uit amiene te maak. Die resulterende diasoniumsoute is reagense in aso-koppelingsreaksies om aso-kleurstowwe te vorm.
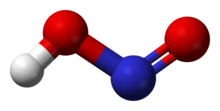
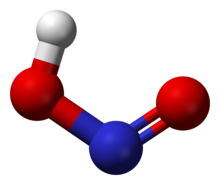
Struktuur
[wysig | wysig bron]In die gasfase rangskik die vier atome wat 'n molekule nitroësuur vorm hulself op 'n plat vlak. Binne daardie vlak het hulle twee moontlike konformasies. Die planêre nitroësuurmolekule kan beide 'n sin- en 'n anti-vorm aanneem. Die anti-vorm oorheers by kamertemperatuur, en infrarooispektroskopie-metings dui aan dat dit meer stabiel is met ongeveer 2,3 kJ/mol.[1]
|
Voorbereiding
[wysig | wysig bron]Nitroësuur word gewoonlik voorberei deur versuring van waterige oplossings van natriumnitriet met 'n minerale suur. Die versuring word gewoonlik by ystemperature uitgevoer. Omdat nitroësuur onstabiel is en vinning ontbind word dit gewoonlik in situ verbruik, dws soos dit voorberei word.[2][3]
Nitroësuur kan ook geproduseer word deur distikstoftrioksied in water op te los volgens die vergelyking
Reaksies
[wysig | wysig bron]Vorming
[wysig | wysig bron]Nitroësuur (HONO or HNO2) kan saam met salpetersuur uit stikstofdioksied en water gevorm word:[4]
Hierdie reaksie is 'n outoredoksreaksie waarin die 4+ oksidasietoestand van stikstof in NO2 oorgaan in +3 in nitroësuur en +5 in salpetersuur. Dit vind veral plaas indien die NO2- en H2O-gasse saam op vaste oppervlakke geadsorbeer word. Hierdie reaksie vind in vogtige, met NOx besoedelde lug plaas, maar dit kan selfs in die huis en veral in die kombuis gebeur. [5]
Ontbinding
[wysig | wysig bron]Sien ook: Distikstoftrioksied
Gasvormige nitroësuur ontbind om stikstofdioksied, stikstofoksied en water te vorm:
In warm of gekonsentreerde oplossings kom die algehele reaksie neer op die produksie van salpetersuur, stikstofoksied en water:
Reduksie
[wysig | wysig bron]Die reduksie-reaksie van nitroësuur word gebruik om baie produkte te skep, insluitend:[6]
Met I−- en Fe2+-ione word stikstofoksied (NO) gevorm:
Met Sn2+-ione word distikstofmonoksied (N2O) gevorm:
Met swaweldioksied-gas (SO2) word hidroksilamien (NH2OH) gevorm:
Met hidrasinium (N2H+5) word ammoniak (HN3) gevorm en daarvan word stikstof-gas (N2) gevorm:
Atmosfeer van die Aarde
[wysig | wysig bron]Nitroësuur is betrokke by die osoonreaksies van die onderste atmosfeer, die troposfeer. Die reaksie van stikstofoksied (NO) en water produseer nitroësuur. Wanneer hierdie reaksie op die oppervlak van atmosferiese deeltjies plaasvind, verander die produk maklik deur reaksie met lig tot hidroksielradikale.[7][8] Hidroksielradikale is hoogs reaktief en ondergaan chemiese reaksies wat hulle kortstondig maak. Wanneer biologiese stelsels aan hidroksielradikale blootgestel word kan dit skade aan selle veroorsaak waar hulle met DNS, lipiede en proteïene kan reageer.[9]
Die Aarde se naghemel word verlig deur verspreide lig wat luggloed genoem word. Dit word word deur stralingsoorgange van atome en molekules geproduseer.[10] Van die mees intense sulke kenmerke wat in die Aarde se naghemel waargeneem is, is 'n groep infrarooi oorgange by golflengtes tussen 700 nanometer en 900 nanometer. In 1950 het Amerikaanse sterrekundige Aden Meinel gewys dat dit oorgange van die hidroksielmolekule was.[11]
Kyk ook
[wysig | wysig bron]Verwysings
[wysig | wysig bron]- ↑ 1,0 1,1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (in Engels) (2de uitg.). Butterworth-Heinemann. p. 462. ISBN 978-0-08-037941-8.
- ↑ Y. Petit, M. Larchevêque (1998). "Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate". Org. Synth. (in Engels). 75: 37. doi:10.15227/orgsyn.075.0037.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser (2002). "Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine". Org. Synth. (in Engels). 78: 51. doi:10.15227/orgsyn.078.0051.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ Kameoka, Yohji; Pigford, Robert (Februarie 1977). "Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous". Ind. Eng. Chem. Fundamen. (in Engels). 16 (1): 163–169. doi:10.1021/i160061a031.
- ↑ Brauer, M., Rasmussen, T.R., Kjærgaard, S.K. and Spengler, J.D. (1993). "Nitrous Acid Formation in an Experimental Exposure Chamber". Indoor Air. 3: 94–105. doi:10.1111/j.1600-0668.1993.t01-2-00004.x.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ Catherine E. Housecroft; Alan G. Sharpe (2008). "The group 15 elements". Inorganic Chemistry (in Engels) (3de uitg.). Pearson. p. 449. ISBN 978-0-13-175553-6.
- ↑ Spataro, F; Ianniello, A (November 2014). "Sources of atmospheric nitrous acid: state of the science, current research needs, and future prospects". Journal of the Air & Waste Management Association (in Engels). 64 (11): 1232–1250. doi:10.1080/10962247.2014.952846. PMID 25509545.
- ↑ Anglada, Josef M.; Solé, Albert (November 2017). "The Atmospheric Oxidation of HONO by OH, Cl, and ClO Radicals". The Journal of Physical Chemistry A (in Engels). 121 (51): 9698–9707. Bibcode:2017JPCA..121.9698A. doi:10.1021/acs.jpca.7b10715. PMID 29182863.
- ↑ Kanno, Taro; Nakamura, Keisuke; Ikai, Hiroyo; Kikuchi, Katsushi; Sasaki, Keiichi; Niwano, Yoshimi (Julie 2012). "Literature review of the role of hydroxyl radicals in chemically-induced mutagenicity and carcinogenicity for the risk assessment of a disinfection system utilizing photolysis of hydrogen peroxide". Journal of Clinical Biochemistry and Nutrition (in Engels). 51 (1): 9–14. doi:10.3164/jcbn.11-105. ISSN 0912-0009. PMC 3391867. PMID 22798706.
- ↑ Silverman, SM (Oktober 1970). "Night airglow phenomenology". Space Science Reviews (in Engels). 11 (2): 341–79. Bibcode:1970SSRv...11..341S. doi:10.1007/BF00241526. S2CID 120677542.
- ↑ Meinel, AB (1950). "OH Emission Bands in the Spectrum of the Night Sky. I". Astrophysical Journal (in Engels). 111: 555–564. Bibcode:1950ApJ...111..555M. doi:10.1086/145296.











![{\displaystyle {\ce {HNO2 + [N2H5]+ -> HN3 + H2O + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ac23b1c9316a3ae317e539e0ce876ac9ee902627)
