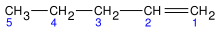Alquenu

Los alquenos son hidrocarburos insaturados que tienen unu o dellos enllaces carbonu-carbonu na so molécula. Puede dicise qu'un alqueno ye un alcano que perdió dos átomos d'hidróxenu produciendo como resultáu un enllaz doble ente dos carbonos. Los alquenos cíclicos reciben el nome de cicloalquenos.
D'antiguo denominábase-yos como olefinas daes les propiedaes que presentaben los sos representantes más simples, principalmente'l eteno, pa reaccionar con halóxenos y producir oleos.
Formulación y nomenclatura de alquenos
[editar | editar la fonte]La fórmula xeneral d'un alquenu de cadena abierta con un namái doble enllaz ye CnH2n. Por cada doble enllaz adicional va haber dos átomos d'hidróxenu menos de los indicaos nesta fórmula.
Nomes tradicionales
[editar | editar la fonte]Al igual qu'asocede con otros compuestos orgánicos, dellos alquenos conócense inda polos sos nomes non sistemáticos, y nesi casu sustitúyese la terminación -enu sistemática por -ilenu, como ye'l casu del etenu que n'ocasiones se llama etilenu, o propenu por propilenu.
Nomenclatura sistemática (IUPAC)
[editar | editar la fonte]1. Nomar al hidrocarburu principal: Haber d'atopar la cadena carbonada más llarga que contenga l'enllaz doble, non necesariamente la de mayor tamañu, asitiando'l localizadores que tengan el menor númberu nos enllaces dobles, numberando los átomos de carbonu na cadena empezando nel estremu más cercanu al enllaz doble. NOTA: Si al numberar d'izquierda a derecha como de derecha a izquierda, el localizadores de les insaturaciones son iguales, búscase que los dobles enllaces tenga menor posición o localizador más baxu.
2. Si la cadena principal tien sustituyentes iguales nel mesmu átomu de carbonu dixebrando por comes los númberos localizadores que se repiten nel átomu, estos dixébrense por un guión de los prefixos: di, tri, tetra, etc. Respeutivamente al númberu de vegaes que se repita'l sustituyente.
3. Los sustituyentes escríbense d'alcuerdu al orde alfabéticu col so respeutivu localizador.
4. Si na cadena principal esisten dellos sustituyentes ramificaos iguales asítiase'l númberu localizador na cadena principal dixebrando por un guión, y escríbese el prefixu correspondiente al númberu de vegaes que se repita colos prefixos: bis, tris, tetraquis, pentaquis, etc. Siguíu d'un paréntesis dientro del cual nómase al sustituyente complexu cola terminación -IL.
5. Realizáu tolo anterior con rellación a los sustituyentes, asítiase'l númberu de localizador del doble enllaz na cadena principal dixebrada d'un guión, siguíu del nome d'alcuerdu al númberu d'átomos de carbonu reemplazando la terminación -anu pol sufixu -enu.
6. Si preséntense más d'un enllaz doble, nómase indicando la posición de cada unu de los dobles enllaces col so respeutivu númberu localizador, escríbese'l raigañu del nome del alqueno del cual provién, siguíu d'un prefixu de cantidá: di, tri, tetra, etc. y utilizando'l sufixu -eno. Ej:-dieno, -trieno y asina socesivamente.
| Fórmula | Encamientos IUPAC-1979 | Encamientos IUPAC-1993[1][2] |
|---|---|---|
| localizador - prefixu de número átomo C (acabáu en -eno) | prefixu de número átomo C - localizador -eno | |
| CH3-CH2-CH=CH2 | 1-buteno | but-1-eno |
Estructura electrónica del enllaz doble C=C
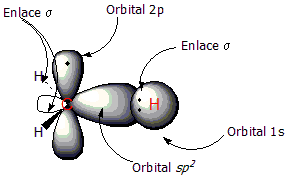
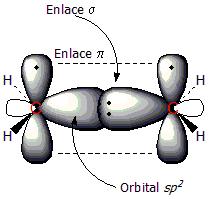
[editar | editar la fonte]Vamos Utilizar l'eteno como exemplu de compuestu con doble enllaz C=C. El doble enllaz tien dos componentes: l'enllaz tipu
Na primer figura puede reparase'l radical metilu, con un orbital sp² qu'enllaza a un átomu d'hidróxenu al carbonu. Na segunda figura apréciase la formación del enllaz
Enerxía d'enllaz
[editar | editar la fonte]Energéticamente, el doble enllaz formar por aciu la edición de dos tipos d'enllaz, el
Síntesis
[editar | editar la fonte]Los alquenos pueden sintetizase por aciu les siguientes reacciones:
- Por cambéu de grupu funcional
- Deshidrohalogenación
- CH3CH2Br + KOH → CH2=CH2 + H2O + KBr
- Deshidratación
- La eliminación d'agua a partir d'alcoholes, por casu:
- CH3CH2OH + H2SO4 → CH3CH2OSU3H + H2O → H2C=CH2 + H2SO4 + H2O ::Tamién
pola reacción de Chugaev y la reacción de Grieco.
- Deshalogenación
- BrCH2CH2Br + Zn → CH2=CH2 + ZnBr2
- Pirólisis (con calor)
- CH3(CH2)4 → CH2=CH2 + CH3CH2CH2CH3
- Por formación d'enlace carbono-carbonu :[[Reacción
de Wittig]]
- Por reacción d'acoplamientu con metales:
Propiedaes físiques
[editar | editar la fonte]La presencia del doble enllaz modifica llixeramente les propiedaes físiques de los alquenos frente a los alcanos. D'elles, la temperatura de ebullición ye la que menos se modificar. La presencia del doble enllaz nótase más n'aspeutos como la polaridá y l'acidez.
Polaridá
[editar | editar la fonte]Dependiendo de la estructura, puede apaecer un momentu dipolar débil.L'enllaz arriendo-alquenilo ta polarizáu na direición del átomu con orbital sp², una y bones la componente s d'un orbital sp² ye mayor que nun sp³ (esto podría interpretase como la proporción de s a p na molécula, siendo 1:2 en sp² y 1:3 en sp³, anque dicha idea ye a cencielles intuitiva). Esto ye por cuenta de que los electrones asitiaos n'orbitales híbridos con mayor componente s tán más amestaos al nucleu que los p, por tanto l'orbital sp² ye llixeramente atrayente d'electrones y apaez una polarización neta escontra él. Una vegada que tenemos polaridá nel enllaz neta, la xeometría de la molécula tien de dexar qu'apaeza un momentu dipolar netu na molécula, como s'aprecia na figura inferior.
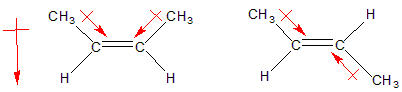
'La primer molécula' ye cis y tenemos un momentu dipolar netu, pero la segunda trans, magar tener dos enllaces llixeramente polarizaos el momentu dipolar netu ye nulu al anulase dambos momentos dipolares.
Acidez
[editar | editar la fonte]El carbonu alquenílico tien mayor acidez frente a los alcanos, debíu tamién a la polaridá del enllaz. Asina, l'etanu (alcano) tien un pKa de 50 (o un Ka de 10-50) frente al pKa = 44 del eteno. Esti fechu esplícase fácilmente considerando que, al esprendese un protón de la molécula, queda una carga negativa remanente que nel casu del eteno se deslocaliza más fácilmente nel enllaz
Reacciones
[editar | editar la fonte]Los alquenos son más reactivos que los alcanos. Les sos reacciones carauterístiques son les de adición d'otres molécules, como haluro d'hidróxenu, hidróxenu y halóxenos. Tamién sufren reacciones de polimerización, bien importantes industrialmente.
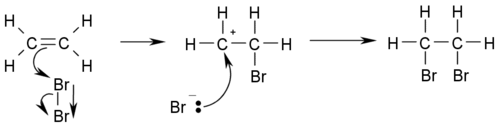
- Hidrohalogenación: referir a la reacción con haluros d'hidróxenu formando alcanos haloxenaos de la manera CH3-CH2=CH2 + HX → CH3CHXCH3. Por casu, halogenación col ácidu HBr:

Estes reacciones tienen de siguir la Regla de Markovnikoff d'enllaces dobles.
- Hidrogenación: referir a la hidrogenación catalítica (usando Pt, Pd, o Ni) formando alcanos de la manera CH2=CH2 + H2 → CH3CH3.
- Halogenación: referir a la reacción con halóxenos (representaos pola X) de la manera CH2=CH2 + X2 → XCH2CH2X. Por casu, halogenación con bromu:
- Polimerización: Formen polímeros de la manera n CH2=CH2 → (-CH2-CH2-)n polímeru, (polietileno nesti casu).
Ver tamién
[editar | editar la fonte]Referencies
[editar | editar la fonte]- ↑ Apuntes de formulación orgánica. Grupu Lentiscal.
- ↑ Nomenclatura-IUPAC-de-Compuestos-Organicos Introducción a la nomenclatura IUPAC de compuestos orgánicos. Eugenio Alvarado. Universidá de Costa Rica.
Enllaces esternos
[editar | editar la fonte]