Fluorid curitý
| Fluorid curitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid curitý |
| Anglický název | Curium(III) fluoride |
| Německý název | Curium(III)-fluorid |
| Sumární vzorec | CmF3 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13708-79-7 |
| PubChem | 101943145 |
| SMILES | F[Cm](F)F |
| InChI | InChI=1S/Cm.3FH/h;3*1H/p-3
Key: GBBPOGITEOLJJQ-UHFFFAOYSA-K |
| Vlastnosti | |
| Molární hmotnost | 304,06556 g/mol |
| Teplota tání | 1406 ± 20 °C |
| Rozpustnost ve vodě | 10 mg·l−1 |
| Struktura | |
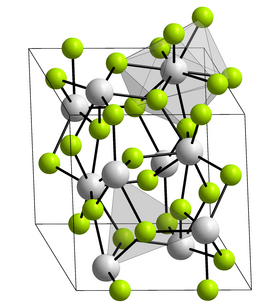
| Krystalová struktura | klencová soustava |
| Hrana krystalové mřížky | a = 699,9 pm
c = 717,9 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie | −1660 kJ·mol−1 |
| Standardní molární entropie S° | 121 J·mol−1*K−1 |
Některá data mohou pocházet z datové položky. | |
Fluorid curitý je anorganická sloučenina s chemickým vzorcem CmF3.
Příprava
[editovat | editovat zdroj]Hydrát fluoridu curitého lze připravit reakcí vodného roztoku curia s ionty fluoru ve slabě kyselém prostředí:
- Cm3+ (aq) + 3 F− (aq) → CmF3 (s)↓
Další možností je reakce hydroxidu curitého s kyselinou fluorovodíkovou, čímž také vzniká hydrát.
Bezvodou sůl lze pak získat vysoušením v exsikátoru s oxidem fosforečným nebo sušením horkým plynným fluorovodíkem.[1]
Vlastnosti
[editovat | editovat zdroj]Fluorid curitý je bezbarvá pevná látka s teplotou tání přibližně 1406 °C, která je téměř nerozpustná ve vodě. Krystalizuje stejně jako fluorid lanthanitý v klencové soustavě s hranami mřížky a = 699,9 pm a c = 717,9 pm.[2] Fluorid curitý je radioaktivní.
Využití
[editovat | editovat zdroj]Fluorid curitý lze redukovat na curium kovovým baryem. Reakce musí probíhat bez přístupu vody a kyslíku v reakční aparatuře z tantalu a wolframu.[3]
- 2 CmF3 + 3 Ba → 2 Cm + 3 BaF2
Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Curium(III) fluoride na anglické Wikipedii a Curium(III) fluoride na německé Wikipedii.
- ↑ LUMETTA, Gregg J.; THOMPSON, Major C.; PENNEMAN, Robert A. Curium. Příprava vydání Lester R. Morss, Norman M. Edelstein, Jean Fuger. Dordrecht: Springer Netherlands Dostupné online. ISBN 978-1-4020-3555-5, ISBN 978-1-4020-3598-2. DOI 10.1007/1-4020-3598-5_9. S. 1397–1443. (anglicky)
- ↑ MAPLE, T. G. Gmelins Handbuch der Anorganischen Chemie. Berlin, Heidelberg: Springer Berlin Heidelberg 102 s. Dostupné online. ISBN 978-3-662-13295-1, ISBN 978-3-662-13294-4.
- ↑ WALLMANN, J. C.; CRANE, W. W. T.; CUNNINGHAM, B. B. The Preparation and Some Properties of Curium Metal. Journal of the American Chemical Society. 1951-01, roč. 73, čís. 1, s. 493–494. Dostupné online [cit. 2023-10-11]. ISSN 0002-7863. DOI 10.1021/ja01145a537. (anglicky)
