Alila alkoholo
| Alila alkoholo | |||
 | |||
| Plata kemia strukturo de la Alila alkoholo | |||
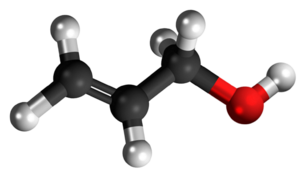 | |||
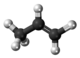
| Tridimensia kemia strukturo de la Alila alkoholo | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 107-18-6 | ||
| ChemSpider kodo | 13872989 | ||
| PubChem-kodo | 7858 | ||
| Merck Index | 15,277 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora, larmiga, brulema, toksa likvaĵo kun penetranta mustardosimila odoro | ||
| Molmaso | 58,08 g·mol−1 | ||
| Denseco | 0,854g cm−3[1] | ||
| Fandpunkto | −129 °C[2] | ||
| Bolpunkto | 96,6 °C[3] | ||
| Refrakta indico | 1,4135 | ||
| Ekflama temperaturo | 22 °C[4] | ||
| Memsparka temperaturo | 378 °C | ||
| Acideco (pKa) | 15,5 | ||
| Solvebleco | Akvo:Malmulte solvebla | ||
| Mortiga dozo (LD50) | 64 mg/kg (buŝe)[5] | ||
| Sekurecaj Indikoj | |||
| Riskoj | R10 R23/24/25 R36/37/38 R50 | ||
| Sekureco | S1/2 S36/37/39 S38 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS Damaĝo Piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H225, H301, H301, H310, H311, H315, H319, H330, H331, H335, H400, H412 | ||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P260, P261, P262, P264, P270, P271, P273, P280, P284, P301+310, P302+352, P303+361+353, P304+340, P305+351+338, P310, P311, P320, P321, P330, P332+313, P337+313, P361, P362, P363[6] | ||
(25 °C kaj 100 kPa) | |||
Alila alkoholo aŭ C3H6O estas organika kombinaĵo apartenanta al la familio de la alkoholoj, senkolora, larmiga, brulema likvaĵo kun penetranta mustardosimila odoro, malmulte solvebla en akvo kaj pli toksa ol aliaj alkoholoj kun malpli da karbonatomoj. Ĝi estas krudmaterialo por produktado de glicerino, sed ankaŭ estas uzata kiel antaŭaĵo al sennombraj specialaj komponaĵo tiaj kiaj flamrezistaj materialoj, sekigaj oleoj kaj plastigaĵoj. Alila alkoholo povas sinteziĝi per pluraj manieroj, ĝi estas la plej eta reprezentaĵo el la alilaj alkoholoj.
Vaporoj de alila alkoholo povas eksplodi en limigitaj areoj. Brulproduktoj povas esti venenaj. La vaporoj estas pli densaj ol la aero kaj fajreroj povas okazi laŭlonge de la vaporvojoj. Ĝi eligas toksajn fumojn kiam hejtata. Ĝi povas eksplode reakcii kun oksidigaj materialoj, karbona kvarklorido, acidoj, natria hidroksido, dualila fosfito, kalia klorido aŭ tribromomelamino.
Ĝi prezentas malaltajn ekflaman temperaturon kaj larĝajn eksplodlimojn. Kun aero ĝi formas eksplodajn miksaĵojn. Ĝi estas neakordigebla kun fortaj oksidigagentoj, fortaj acidoj, dualilaj fosfitoj, metalaj halogenidoj, natria hidroksido, kvarklorometano, tribromoanilino, natrio, kalio, magnezio kaj aluminio. Longedaŭraj ekspozicioj kaŭzas polimerizaĵojn.
| Struktura geometrio: C3H6O | |||
 |
 |
 |
 |
 |
 |
 |
 |
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado per traktado de alila jodido kun natria hidroksido:
Sintezo 2
[redakti | redakti fonton]- Preparado per kataliza oksidado de la propanolo:
Sintezo 3
[redakti | redakti fonton]- Preparado per traktado de alila klorido kun natria hidroksido:
Sintezo 4
[redakti | redakti fonton]- Preparado per hidratigo de la propeno:
Sintezo 5
[redakti | redakti fonton]- Preparado per molekula rearanĝo de la propilena oksido:
Sintezo 6
[redakti | redakti fonton]- Preparado per senhidratigo de la glicerino en ĉeesto de formiata acido:[7]
Sintezo 7
[redakti | redakti fonton]Sintezo 8
[redakti | redakti fonton]- Preparado per reakcio inter alila klorido kaj arĝenta hidroksido:
Sintezo 9
[redakti | redakti fonton]- Reakcio de alilamino kun nitrita acido:
Sintezo 10
[redakti | redakti fonton]- Preparado per interagado de alila benzoato kaj kalia hidroksido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Preparado de dualila ftalato:
Reakcio 2
[redakti | redakti fonton]- Preparado de alila jodido:
Reakcio 3
[redakti | redakti fonton]- Preparado de alila klorido:
Reakcio 4
[redakti | redakti fonton]- Reakcio kun fosfora triklorido:
Reakcio 5
[redakti | redakti fonton]- Reakcio kun fosfora triklorido:
Reakcio 6
[redakti | redakti fonton]- Reakcio kun fosfora tribromido:
Reakcio 7
[redakti | redakti fonton]- Reakcio kun tionila klorido:
Reakcio 8
[redakti | redakti fonton]- Reakcio kun acetila klorido:
Reakcio 9
[redakti | redakti fonton]- Preparado de alila cianido:
Reakcio 10
[redakti | redakti fonton]- Preparado de alilamino:
Literaturo
[redakti | redakti fonton]- Remington: The Science and Practice of Pharmacy
- Hand Book of Chemistry
- HNE and Further Lipid Peroxidation Products
- The Liver: Morphology, Biochemistry, Physiology
- Advances in Catalysis
- Heterogeneous Catalysis and Fine Chemicals
Referencoj
[redakti | redakti fonton]- ↑ Chemical Book
- ↑ Fisher Scientific
- ↑ University of Hertfordshire
- ↑ Sigma Aldrich
- ↑ Fisher Scientific. Arkivita el la originalo je 2019-01-23. Alirita 2019-01-22.
- ↑ PubChem
- ↑ PrepChem







![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)

![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{-2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3ecf644066213e1758e22341790bab6a5f0de89)

![{\displaystyle {\mathsf {{\xrightarrow[{-2\,H_{2}O\,-CO_{2}}]{+\,HCOOH}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22d978fdd8ada2410111083bf746532bb6274e19)






