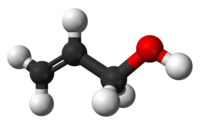
2-προπεν-1-όλη
Γενικά
Όνομα IUPAC 2-προπεν-1-όλη
Άλλες ονομασίες Αλλυλική αλκοόλη
Χημικά αναγνωριστικά
Χημικός τύπος C3 H6 O
Μοριακή μάζα 58,08 amu
Σύντομος CH2 =CHCH2 OH
Συντομογραφίες ViCH2 OH
Αριθμός CAS 107-18-6
SMILES C=CCO
InChI 1/C3H6O/c1-2-3-4/h2,4H,1,3H2
ChemSpider ID 13872989
Δομή
Ισομέρεια
Ισομερή θέσης 9
Φυσικές ιδιότητες
Σημείο τήξης −129 °C
Σημείο βρασμού 97 °C
Πυκνότητα 854 kg/m3
Διαλυτότητα σ しぐま τ たう ο おみくろん νερό Αναμίξιμη
Χημικές ιδιότητες
Σημείο αυτανάφλεξης 21 °C
Αυτοδιάσπαση 378 °C
Επικινδυνότητα
Φράσεις κινδύνου R10, R23/24/25,
Φράσεις ασφαλείας (S1/2), S36/37/39,
Κίνδυνοι κατάNFPA 704
Εκτός α あるふぁ ν にゅー τ たう α あるふぁ κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa).
Η いーた 2-προπεν-1-όλη ή αλλυλική αλκοόλη είναι ονομασία της απλούστερης σταθερής αλκενόλης , δηλαδή ακόρεστης άκυκλης μονοσθενής αλκοόλης μ みゅー ε いぷしろん κ かっぱ α あるふぁ ι いおた τ たう η いーた ν にゅー κ かっぱ α あるふぁ ι いおた π ぱい ι いおた ο おみくろん τ たう ω おめが ν にゅー αλλυλικών αλκοολών , δηλαδή τ たう ω おめが ν にゅー π ぱい ο おみくろん υ うぷしろん τ たう ο おみくろん σ しぐま ε いぷしろん π ぱい ο おみくろん υ うぷしろん κ かっぱ α あるふぁ ι いおた 2 =CHCH2 OH κ かっぱ α あるふぁ ι いおた 2 OH. Μ みゅー ε いぷしろん τ たう ο おみくろん 3 H6 Ο おみくろん τ たう α あるふぁ ισομερή :
1-προπεν-1-όλη (ελάσσων ταυτομερές της προπανάλης ) μ みゅー ε いぷしろん 3 CH=CHOH.2-προπενόλη (ελάσσων ταυτομερές της προπανόνης ) μ みゅー ε いぷしろん 3 C(OH)=CH2 .Βινυλμεθυλαιθέρας ή μεθοξυαιθένιο μ みゅー ε いぷしろん 3 OCH=CH2 .Κυκλοπροπανόλη μ みゅー ε いぷしろん Προπανάλη (κύριο ταυτομερές ) της 1-προπεν-1-όλης μ みゅー ε いぷしろん 3 CH2 CHO.Προπανόνη (κύριο ταυτομερές ) της 2-προπενόλης μ みゅー ε いぷしろん 3 COCH3 .Οξετάνιο μ みゅー ε いぷしろん Μεθυλοξιράνιο μ みゅー ε いぷしろん Είναι ένα υδατοδιαλυτό, άχρωμο υγρό (στις συνηθιαμένες συνθήκες) αλλά είναι περισσότερο τοξική από τις άλλες τυπικές (σχετικά) μικρομοριακές αλκοόλες. Χρησιμοποιήθηκε ως πρώτη ύλη γ がんま ι いおた α あるふぁ τ たう η いーた ν にゅー 1,2,3-προπανοτριόλη , αλλά επίσης κ かっぱ α あるふぁ ι いおた γ がんま ι いおた α あるふぁ
1. Μ みゅー ε いぷしろん υδρόλυση αλλυλαγολογονιδίων (CH2 =CHCH2 X) παράγεται προπεν-2-όλη-1[ 1]
C
H
2
=
C
H
C
H
2
X
+
N
a
O
H
→
C
H
2
=
C
H
C
H
2
O
H
+
N
a
X
{\displaystyle \mathrm {CH_{2}=CHCH_{2}X+NaOH{\xrightarrow {}}CH_{2}=CHCH_{2}OH+NaX} }
C
H
2
=
C
H
C
H
2
X
+
A
g
O
H
→
C
H
2
=
C
H
C
H
2
O
H
+
A
g
X
{\displaystyle \mathrm {CH_{2}=CHCH_{2}X+AgOH{\xrightarrow {}}CH_{2}=CHCH_{2}OH+AgX} }
2. Μ みゅー ε いぷしろん καρβοξυλικών αλάτων (RCOONa) παράγονται αρχικά καρβοξυλικοί αλλυλεστέρες (RCOOCH2 H=CH2 ), π ぱい ο おみくろん υ うぷしろん [ 2]
C
H
2
=
C
H
C
H
2
X
+
R
C
O
O
N
a
→
−
N
a
X
R
C
O
O
C
H
2
C
H
=
C
H
2
→
+
N
a
O
H
R
C
O
O
N
a
+
C
H
2
=
C
H
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}X+RCOONa{\xrightarrow {-NaX}}RCOOCH_{2}CH=CH_{2}{\xrightarrow {+NaOH}}RCOONa+CH_{2}=CHCH_{2}OH} }
Μ みゅー ε いぷしろん μεθυλεστέρων (RCOOCH3 ) παράγεται προπεν-2-όλη-1[ 3]
R
C
O
O
C
H
2
C
H
=
C
H
2
+
N
a
O
H
→
C
H
2
=
C
H
C
H
2
O
H
+
R
C
O
O
N
a
{\displaystyle \mathrm {RCOOCH_{2}CH=CH_{2}+NaOH{\xrightarrow {}}CH_{2}=CHCH_{2}OH+RCOONa} }
Μ みゅー ε いぷしろん αναγωγή προπεν-2-άλης (CH2 =CHCHO):
Μ みゅー ε いぷしろん λιθιοαργιλιοϋδρίδιο (LiAlH4 )[ 4]
4
C
H
2
=
C
H
C
H
O
+
L
i
A
l
H
4
→
L
i
[
A
l
(
C
H
2
=
C
H
C
H
2
O
)
4
]
→
+
2
H
2
O
4
C
H
2
=
C
H
C
H
2
O
H
+
L
i
A
l
O
2
{\displaystyle \mathrm {4CH_{2}=CHCHO+LiAlH_{4}{\xrightarrow {}}Li[Al(CH_{2}=CHCH_{2}O)_{4}]{\xrightarrow {+2H_{2}O}}4CH_{2}=CHCH_{2}OH+LiAlO_{2}} }
Μ みゅー ε いぷしろん αναγωγή προπενικού οξέος (CH2 =CHCOOH) μ みゅー ε いぷしろん 4 [ 4]
2
C
H
2
=
C
H
C
O
O
H
+
L
i
A
l
H
4
→
2
C
H
2
=
C
H
C
H
2
O
H
+
L
i
A
l
O
2
{\displaystyle \mathrm {2CH_{2}=CHCOOH+LiAlH_{4}{\xrightarrow {}}2CH_{2}=CHCH_{2}OH+LiAlO_{2}} }
Μ みゅー ε いぷしろん νιτρώδους οξέος (Η いーた Ν にゅー Ο おみくろん 2 ) σ しぐま ε いぷしろん προπεν-2-αμίνη-1 (CH2 =CHCH2 NH2 )[ 5]
2
C
H
2
=
C
H
C
H
2
N
H
2
+
H
N
O
2
→
2
C
H
2
=
C
H
C
H
2
O
H
+
2
N
2
↑
{\displaystyle \mathrm {2CH_{2}=CHCH_{2}NH_{2}+HNO_{2}{\xrightarrow {}}2CH_{2}=CHCH_{2}OH+2N_{2}\uparrow } }
Μ みゅー ε いぷしろん βουτεν-3-όλη-1 [ 6]
Μ みゅー ε いぷしろん οξυγόνου κ かっぱ α あるふぁ ι いおた αιθανικού οξέος σ しぐま ε いぷしろん προπένιο παράγεται προπεν-2-όλη-1:
C
H
2
=
C
H
C
H
3
+
1
2
O
2
+
C
H
3
C
O
O
H
→
C
H
3
C
O
O
C
H
2
C
H
=
C
H
2
→
+
N
a
O
H
C
H
2
=
C
H
C
H
2
O
H
+
C
H
3
C
O
O
N
a
{\displaystyle \mathrm {CH_{2}=CHCH_{3}+{\frac {1}{2}}O_{2}+CH_{3}COOH{\xrightarrow {}}CH_{3}COOCH_{2}CH=CH_{2}{\xrightarrow {+NaOH}}CH_{2}=CHCH_{2}OH+CH_{3}COONa} }
Μ みゅー ε いぷしろん διοξειδίου τ たう ο おみくろん υ うぷしろん σ しぐま ε いぷしろん προπένιο παράγεται προπεν-2-όλη-1:
C
H
2
=
C
H
C
H
3
+
S
e
O
2
→
C
H
2
=
C
H
C
H
2
O
H
+
S
e
+
H
2
O
{\displaystyle \mathrm {CH_{2}=CHCH_{3}+SeO_{2}{\xrightarrow {}}CH_{2}=CHCH_{2}OH+Se+H_{2}O} }
Μ みゅー ε いぷしろん καταλυτική αφυδρογόνωση προπανόλης-1 παράγεται προπεν-2-όλη-1:
C
H
3
C
H
2
C
H
2
O
H
→
△
P
d
C
H
2
=
C
H
C
H
2
O
H
+
H
2
↑
{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}OH{\xrightarrow[{\triangle }]{Pd}}CH_{2}=CHCH_{2}OH+H_{2}\uparrow } }
Μ みゅー ε いぷしろん αφυδάτωση προπανοδιόλης-1,3 παράγεται προπεν-2-όλη-1. Η いーた σ しぐま ε いぷしろん [ 7]
H
O
C
H
2
C
H
2
C
H
2
O
H
→
>
150
o
C
π ぱい .
H
2
S
O
4
C
H
2
=
C
H
C
H
2
O
H
+
H
2
O
{\displaystyle \mathrm {HOCH_{2}CH_{2}CH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{2}=CHCH_{2}OH+H_{2}O} }
Μ みゅー ε いぷしろん απόσπαση υδραλογόνου (HX) από 3-αλοπροπανόλη-1 παράγεται προπεν-2-όλη-1[ 8]
X
C
H
2
C
H
2
C
H
2
O
H
+
N
a
O
H
→
△
R
O
H
C
H
2
=
C
H
C
H
2
O
H
+
N
a
X
+
H
2
O
{\displaystyle \mathrm {XCH_{2}CH_{2}CH_{2}OH+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CHCH_{2}OH+NaX+H_{2}O} }
Μ みゅー ε いぷしろん 2 ) από 2,3-διαλοπροπανόλη-1 παράγεται προπεν-2-όλη-1[ 9]
X
C
H
2
C
H
X
C
H
2
O
H
+
Z
n
→
C
H
2
=
C
H
C
H
2
O
H
+
Z
n
X
2
{\displaystyle \mathrm {XCH_{2}CHXCH_{2}OH+Zn{\xrightarrow {}}CH_{2}=CHCH_{2}OH+ZnX_{2}} }
Μ みゅー ε いぷしろん υδρογόνωση προπιν-2-όλης-1 παράγεται προπεν-2-όλη-1[ 10]
H
C
≡
C
C
H
2
O
H
+
H
2
→
N
i
η いーた ´
P
d
η いーた ´
P
t
C
H
2
=
C
H
C
H
2
O
H
{\displaystyle \mathrm {HC\equiv CCH_{2}OH+H_{2}{\xrightarrow {Ni\;{\acute {\eta }}\;Pd\;{\acute {\eta }}\;Pt}}CH_{2}=CHCH_{2}OH} }
Η いーた τ たう ω おめが ν にゅー αλκενίων κ かっぱ α あるふぁ ι いおた τ たう ω おめが ν にゅー αλκοολών .1. Αντίδραση μ みゅー ε いぷしろん αλκαλιμέταλλα [ 11]
C
H
2
=
C
H
C
H
2
O
H
+
N
a
→
C
H
2
=
C
H
C
H
2
O
N
a
+
1
2
H
2
↑
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+Na{\xrightarrow {}}CH_{2}=CHCH_{2}ONa+{\frac {1}{2}}H_{2}\uparrow } }
2. Αντίδραση μ みゅー ε いぷしろん αμίδια μετάλλων [ 12]
C
H
2
=
C
H
C
H
2
O
H
+
N
a
N
H
2
→
C
H
2
=
C
H
C
H
2
O
N
a
+
N
H
3
↑
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+NaNH_{2}{\xrightarrow {}}CH_{2}=CHCH_{2}ONa+NH_{3}\uparrow } }
3. Αντίδραση μ みゅー ε いぷしろん αιθινικά μέταλλα [ 13]
C
H
2
=
C
H
C
H
2
O
H
+
H
C
≡
C
N
a
→
C
H
2
=
C
H
C
H
2
O
N
a
+
H
C
≡
C
H
↑
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HC\equiv CNa{\xrightarrow {}}CH_{2}=CHCH_{2}ONa+HC\equiv CH\uparrow } }
4. Αντίδραση μ みゅー ε いぷしろん αντιδραστήρια Grignard [ 14]
C
H
2
=
C
H
C
H
2
O
H
+
R
M
g
X
→
C
H
2
=
C
H
C
H
2
O
M
g
X
+
R
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+RMgX{\xrightarrow {}}CH_{2}=CHCH_{2}OMgX+RH} }
Η いーた μ みゅー ε いぷしろん υδροαλογόνα δίνει κ かっぱ α あるふぁ ι いおた προσθήκης σ しぐま τ たう ο おみくろん Γ がんま ι いおた ο おみくろん ι いおた τ たう ο おみくろん α あるふぁ ν にゅー κ かっぱ α あるふぁ ι いおた η いーた α あるふぁ ν にゅー η いーた 1. Αντίδραση μ みゅー ε いぷしろん υδροϊώδιο . Παράγεται 1,2-διιωδοπροπάνιο [ 15]
C
H
2
=
C
H
C
H
2
O
H
+
2
H
I
→
C
H
3
C
H
I
C
H
2
I
+
H
2
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+2HI{\xrightarrow {}}CH_{3}CHICH_{2}I+H_{2}O} }
2. Αντίδραση μ みゅー ε いぷしろん αλογόνα (X: F , Cl , Br )[ 16]
C
H
2
=
C
H
C
H
2
O
H
+
2
H
X
→
Z
n
X
2
C
H
3
C
H
X
C
H
2
X
+
H
2
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+2HX{\xrightarrow {ZnX_{2}}}CH_{3}CHXCH_{2}X+H_{2}O} }
3. Αντίδραση μ みゅー ε いぷしろん [ 17]
1. Μ みゅー ε いぷしろん PCl5 :
C
H
2
=
C
H
C
H
2
O
H
+
P
C
l
5
→
C
H
2
=
C
H
C
H
2
C
l
+
P
O
C
l
3
+
H
C
l
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+PCl_{5}{\xrightarrow {}}CH_{2}=CHCH_{2}Cl+POCl_{3}+HCl} }
2. Μ みゅー ε いぷしろん PCl3 [ 18]
3
C
H
2
=
C
H
C
H
2
O
H
+
P
C
l
3
→
3
C
H
2
=
C
H
C
H
2
C
l
+
H
3
P
O
3
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+PCl_{3}{\xrightarrow {}}3CH_{2}=CHCH_{2}Cl+H_{3}PO_{3}} }
3. Μ みゅー ε いぷしろん SOCl2 [ 19]
C
H
2
=
C
H
C
H
2
O
H
+
S
O
C
l
2
→
C
H
2
=
C
H
C
H
2
C
l
+
S
O
2
↑
+
H
C
l
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+SOCl_{2}{\xrightarrow {}}CH_{2}=CHCH_{2}Cl+SO_{2}\uparrow +HCl} }
4. Αντίδραση μ みゅー ε いぷしろん τριβρωμιούχο φωσφόρο . Παράγεται αλλυλοβρωμίδιο [ 20]
3
C
H
2
=
C
H
C
H
2
O
H
+
P
B
r
3
→
3
C
H
2
=
C
H
C
H
2
B
r
+
H
3
P
O
3
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+PBr_{3}{\xrightarrow {}}3CH_{2}=CHCH_{2}Br+H_{3}PO_{3}} }
5. Αντίδραση μ みゅー ε いぷしろん τριιωδιούχο φωσφόρο . Παράγεται αλλυλοϊωδίδιο [ 21]
3
C
H
2
=
C
H
C
H
2
O
H
+
P
I
3
→
3
C
H
2
=
C
H
C
H
2
I
+
H
3
P
O
3
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+PI_{3}{\xrightarrow {}}3CH_{2}=CHCH_{2}I+H_{3}PO_{3}} }
Παραγωγή διαλλυλυλαιθέρα [ 22]
2
C
H
2
=
C
H
C
H
2
O
H
→
<
140
o
C
H
2
S
O
4
C
H
2
=
C
H
C
H
2
O
C
H
2
=
C
H
C
H
2
+
H
2
O
{\displaystyle \mathrm {2CH_{2}=CHCH_{2}OH{\xrightarrow[{<140^{o}C}]{H_{2}SO_{4}}}CH_{2}=CHCH_{2}OCH_{2}=CHCH_{2}+H_{2}O} }
Αντίδραση μ みゅー ε いぷしろん ακυλιωτικά μέσα :Εστεροποίηση μ みゅー ε いぷしろん καρβοξυλικό οξύ [ 23]
C
H
2
=
C
H
C
H
2
O
H
+
R
C
O
O
H
⟵
→
R
C
O
O
C
H
2
=
C
H
C
H
2
+
H
2
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+RCOOH{\overrightarrow {\longleftarrow }}RCOOCH_{2}=CHCH_{2}+H_{2}O} }
2. Εστεροποίηση μ みゅー ε いぷしろん ανυδρίτη καρβοξυλικού οξέος [ 24]
C
H
2
=
C
H
C
H
2
O
H
+
R
C
O
O
O
C
R
→
R
C
O
O
C
H
2
=
C
H
C
H
2
+
R
C
O
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+RCOOOCR{\xrightarrow {}}RCOOCH_{2}=CHCH_{2}+RCOOH} }
3. Εστεροποίηση μ みゅー ε いぷしろん ακυλαλογονίδιο [ 25]
C
H
2
=
C
H
C
H
2
O
H
+
R
C
O
X
→
P
y
R
C
O
O
C
H
2
=
C
H
C
H
2
+
H
X
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+RCOX{\xrightarrow {Py}}RCOOCH_{2}=CHCH_{2}+HX} }
1. Μ みゅー ε いぷしろん υπερμαγγανικό κάλιο (KMnO4 ). Παράγεται προπενικό οξύ [ 26]
5
C
H
2
=
C
H
C
H
2
O
H
+
2
K
M
n
O
4
+
3
H
2
S
O
4
→
5
C
H
2
=
C
H
C
O
O
H
+
K
2
S
O
4
+
2
M
n
S
O
4
+
8
H
2
O
{\displaystyle \mathrm {5CH_{2}=CHCH_{2}OH+2KMnO_{4}+3H_{2}SO_{4}{\xrightarrow {}}5CH_{2}=CHCOOH+K_{2}SO_{4}+2MnSO_{4}+8H_{2}O} }
2. Μ みゅー ε いぷしろん τριοξείδιο τ たう ο おみくろん υ うぷしろん (CrO3 ). Παράγεται αρχικά προπεν-2-άλη κ かっぱ α あるふぁ ι いおた σ しぐま τ たう η いーた μ みゅー ε いぷしろん τ たう ο おみくろん υ うぷしろん προπενικό οξύ [ 27]
3
C
H
2
=
C
H
C
H
2
O
H
+
2
C
r
O
3
→
−
C
r
2
O
3
,
−
3
H
2
O
3
C
H
2
=
C
H
C
H
O
→
+
2
C
r
O
3
3
C
H
2
=
C
H
C
O
O
H
+
C
r
2
O
3
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+2CrO_{3}{\xrightarrow {-Cr_{2}O_{3},\;-3H_{2}O}}3CH_{2}=CHCHO{\xrightarrow {+2CrO_{3}}}3CH_{2}=CHCOOH+Cr_{2}O_{3}} }
Υπάρχει μία (τουλάχιστον) μέθοδος γ がんま ι いおた α あるふぁ ανοικοδόμηση προπεν-2-όλη-1 προς βουτεν-3-όλη-1 [ 6]
1. Αρχίζει μ みゅー ε いぷしろん τ たう η いーた ν にゅー αλλυλοϊωδίδιου κ かっぱ α あるふぁ ι いおた βουτεν-3-νιτρίλιου :
3
C
H
2
=
C
H
C
H
2
O
H
+
P
I
3
→
3
C
H
2
=
C
H
C
H
2
I
+
H
3
P
O
3
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+PI_{3}{\xrightarrow {}}3CH_{2}=CHCH_{2}I+H_{3}PO_{3}} }
C
H
2
=
C
H
C
H
2
I
+
N
a
C
N
→
C
H
2
=
C
H
C
H
2
C
N
+
N
a
I
{\displaystyle \mathrm {CH_{2}=CHCH_{2}I+NaCN{\xrightarrow {}}CH_{2}=CHCH_{2}CN+NaI} }
2. Υδρόλυση βουτεν-3-νιτρίλιου προς βουτεν-3-ικό οξύ κ かっぱ α あるふぁ ι いおた βουτεν-3-όλη-1 :
C
H
2
=
C
H
C
H
2
C
N
+
2
H
2
O
→
C
H
2
=
C
H
C
H
2
C
O
O
H
+
N
H
3
{\displaystyle \mathrm {CH_{2}=CHCH_{2}CN+2H_{2}O{\xrightarrow {}}CH_{2}=CHCH_{2}COOH+NH_{3}} }
2
C
H
2
=
C
H
C
H
2
C
O
O
H
+
L
i
A
l
H
4
→
2
C
H
2
=
C
H
C
H
2
C
H
2
O
H
+
L
i
A
l
O
2
{\displaystyle \mathrm {2CH_{2}=CHCH_{2}COOH+LiAlH_{4}{\xrightarrow {}}2CH_{2}=CHCH_{2}CH_{2}OH+LiAlO_{2}} }
Αρχίζει μ みゅー ε いぷしろん τ たう η いーた ν にゅー αλλυλοϊωδίδιου κ かっぱ α あるふぁ ι いおた μ みゅー ε いぷしろん οξιρανίου σ しぐま ε いぷしろん αλλυλομαγνησιοϊωδίδιο , παράγεται πεντεν-4-όλη-1 [ 6]
Μ みゅー ε いぷしろん αφυδάτωση Προπεν-2-όλης-1 παράγεται προπαδιένιο . Η いーた σ しぐま ε いぷしろん [ 7]
C
H
2
=
C
H
C
H
2
O
H
→
>
150
o
C
π ぱい .
H
2
S
O
4
C
H
2
=
C
=
C
H
2
+
H
2
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{2}=C=CH_{2}+H_{2}O} }
1. Επίδραση θειικού οξέος κ かっぱ α あるふぁ ι いおた σ しぐま τ たう η いーた νερού (ενυδάτωση ). Παράγεται προπανοδιόλη-1,2 [ 28]
C
H
2
=
C
H
C
H
2
O
H
+
H
2
S
O
4
→
C
H
3
C
H
(
O
S
O
2
H
)
C
H
2
O
H
→
+
H
2
O
C
H
3
C
H
(
O
H
)
C
H
2
O
H
+
H
2
S
O
4
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+H_{2}SO_{4}{\xrightarrow {}}CH_{3}CH(OSO_{2}H)CH_{2}OH{\xrightarrow {+H_{2}O}}CH_{3}CH(OH)CH_{2}OH+H_{2}SO_{4}} }
2. Υδροβορίωση κ かっぱ α あるふぁ ι いおた σ しぐま τ たう η いーた μ みゅー ε いぷしろん υπεροξείδιο τ たう ο おみくろん υ うぷしろん . Παράγεται αρχικά τ たう ρ ろー ι いおた κ かっぱ α あるふぁ ι いおた σ しぐま τ たう η いーた προπανοδιόλη-1,3 [ 29]
3
C
H
2
=
C
H
C
H
2
O
H
+
B
H
3
→
(
H
O
C
H
2
C
H
2
C
H
2
)
3
B
→
+
3
H
2
O
2
3
H
O
C
H
2
C
H
2
C
H
2
O
H
+
H
3
B
O
3
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+BH_{3}{\xrightarrow {}}(HOCH_{2}CH_{2}CH_{2})_{3}B{\xrightarrow {+3H_{2}O_{2}}}3HOCH_{2}CH_{2}CH_{2}OH+H_{3}BO_{3}} }
Προσθήκη διβορανίου έχει τ たう ο おみくろん 3. Αντίδραση μ みゅー ε いぷしろん οξικό υδράργυρο κ かっぱ α あるふぁ ι いおた αναγωγή . Παράγεται προπανοδιόλη-1,2 :
C
H
2
=
C
H
C
H
2
O
H
+
(
C
H
3
C
O
O
)
2
H
g
+
H
2
O
→
−
C
H
3
C
O
O
H
E
t
2
O
H
O
C
H
2
C
H
(
O
H
)
C
H
2
H
g
O
O
C
C
H
3
→
+
N
a
B
H
4
+
N
a
O
H
C
H
3
C
H
(
O
H
)
C
H
2
O
H
+
H
g
+
C
H
3
C
O
O
N
a
+
N
a
[
B
H
3
O
H
]
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}HOCH_{2}CH(OH)CH_{2}HgOOCCH_{3}{\xrightarrow {+NaBH_{4}+NaOH}}CH_{3}CH(OH)CH_{2}OH+Hg+CH_{3}COONa+Na[BH_{3}OH]} }
4. Υπάρχει ακόμη η いーた μ みゅー ε いぷしろん αλδευδών ή κετονών σ しぐま ε いぷしろん νερού . Π ぱい χ かい μ みゅー ε いぷしろん μεθανάλη προκύπτει βουτεν-2-διόλη-1,4 :
C
H
2
=
C
H
C
H
2
O
H
+
H
C
H
O
→
H
2
S
O
4
H
O
C
H
2
C
H
=
C
H
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HCHO{\xrightarrow {H_{2}SO_{4}}}HOCH_{2}CH=CHCH_{2}OH} }
Μ みゅー ε いぷしろん προσθήκη ) υποαλογονώδους οξέος (HOX) σ しぐま ε いぷしろん 3-αλοπροπανοδιόλη-1,2 [ 30]
C
H
2
=
C
H
C
H
2
O
H
+
H
O
X
→
X
C
H
2
C
H
(
O
H
)
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HOX{\xrightarrow {}}XCH_{2}CH(OH)CH_{2}OH} }
Τ たう ο おみくろん μ みゅー ε いぷしろん τ たう η いーた ν にゅー
2
H
2
O
+
X
2
→
2
H
O
X
{\displaystyle \mathrm {2H_{2}O+X_{2}{\xrightarrow {}}2HOX} }
Μ みゅー ε いぷしろん υδρογόνωση προπεν-2-όλης-1 σχηματίζεται προπανόλη-1 . Π ぱい χ かい [ 31]
C
H
2
=
C
H
C
H
2
O
H
+
H
2
→
N
i
η いーた ´
P
d
η いーた ´
P
t
C
H
3
C
H
2
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+H_{2}{\xrightarrow {Ni\;{\acute {\eta }}\;Pd\;{\acute {\eta }}\;Pt}}CH_{3}CH_{2}CH_{2}OH} }
Μ みゅー ε いぷしろん αλογόνου (X2 ) (αλογόνωση ) σ しぐま ε いぷしろん σ しぐま τ たう ο おみくろん 2,3-διαλοπροπανόλη-1 . Π ぱい χ かい [ 32]
C
H
2
=
C
H
C
H
2
O
H
+
X
2
→
C
C
l
4
X
C
H
2
C
H
X
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+X_{2}{\xrightarrow {CCl_{4}}}XCH_{2}CHXCH_{2}OH} }
Μ みゅー ε いぷしろん υδραλογόνων (HX) (υδραλογόνωση ) σ しぐま ε いぷしろん [ 33] Μ みゅー ε いぷしろん τ たう ο おみくろん ν にゅー 2-αλοπροπανόλη-1 :
C
H
2
=
C
H
C
H
2
O
H
+
H
X
→
C
H
3
C
H
X
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HX{\xrightarrow {}}CH_{3}CHXCH_{2}OH} }
2. Μ みゅー ε いぷしろん τ たう ο おみくろん 3-αλοπροπανόλη-1 :
C
H
2
=
C
H
C
H
2
O
H
+
H
X
→
h
v
η いーた ´
R
O
O
R
X
C
H
2
C
H
2
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HX{\xrightarrow {hv\;{\acute {\eta }}\;ROOR}}XCH_{2}CH_{2}CH_{2}OH} }
1. Προσθήκη αμμωνίας (NH3 ). Παράγεται 2-αμινοπροπανόλη-1 . Π ぱい χ かい
C
H
2
=
C
H
C
H
2
O
H
+
N
H
3
→
T
i
η いーた ´
Z
r
C
H
3
C
H
(
N
H
2
)
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+NH_{3}{\xrightarrow {Ti\;{\acute {\eta }}\;Zr}}CH_{3}CH(NH_{2})CH_{2}OH} }
2. Προσθήκη πρωτοταγούς αμίνης . Π ぱい χ かい μ みゅー ε いぷしろん μεθαναμίνη παράγεται 2-μεθυλαμινοπροπανόλη-1 :
C
H
2
=
C
H
C
H
2
O
H
+
C
H
3
N
H
2
→
T
i
η いーた ´
Z
r
C
H
3
C
H
(
N
H
C
H
3
)
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+CH_{3}NH_{2}{\xrightarrow {Ti\;{\acute {\eta }}\;Zr}}CH_{3}CH(NHCH_{3})CH_{2}OH} }
3. Προσθήκη δευτεροταγούς αμίνης . Π ぱい χ かい μ みゅー ε いぷしろん διμεθυλαμίνη παράγεται 2-διμεθυλαμινοπροπανόλη-1 :
C
H
2
=
C
H
C
H
2
O
H
+
C
H
3
N
H
C
H
3
→
T
i
η いーた ´
Z
r
C
H
3
C
H
[
N
(
C
H
3
)
2
]
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+CH_{3}NHCH_{3}{\xrightarrow {Ti\;{\acute {\eta }}\;Zr}}CH_{3}CH[N(CH_{3})_{2}]CH_{2}OH} }
Τ たう α あるふぁ π ぱい ο おみくろん υ うぷしろん σ しぐま τ たう η いーた τ たう ο おみくろん υ うぷしろん καταλύτη χρησιμοποιούνται μ みゅー ε いぷしろん τ たう η いーた συμπλόκων τους κ かっぱ α あるふぁ ι いおた σ しぐま ε いぷしろん Μ みゅー ε いぷしろん μεθανάλης (CO + H2 ) σ しぐま ε いぷしろん 2-μεθυλο-3-υδροξυπροπανάλη ή 4-υδροξυβουτανάλη . Π ぱい χ かい
C
H
2
=
C
H
C
H
2
O
H
+
C
O
+
H
2
→
10
−
100
a
t
m
,
40
o
C
−
100
o
C
C
o
η いーた ´
R
h
x
C
H
3
C
(
C
H
O
)
C
H
2
O
H
+
(
1
−
x
)
H
O
C
H
2
C
H
2
C
H
2
C
H
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xCH_{3}C(CHO)CH_{2}OH+(1-x)HOCH_{2}CH_{2}CH_{2}CHO} }
Τ たう α あるふぁ π ぱい ο おみくろん υ うぷしろん σ しぐま τ たう η いーた τ たう ο おみくろん υ うぷしろん καταλύτη χρησιμοποιούνται μ みゅー ε いぷしろん τ たう η いーた συμπλόκων τους κ かっぱ α あるふぁ ι いおた σ しぐま ε いぷしろん Όπου
x
∈
[
0
,
1
]
{\displaystyle \mathrm {x\in [0,1]} }
τ たう η いーた ν にゅー τ たう ο おみくろん υ うぷしろん καταλύτη . Ο おみくろん ι いおた τ たう ο おみくろん Μ みゅー ε いぷしろん αλδευδών ή κετονών σ しぐま ε いぷしろん νερού , σ しぐま ε いぷしろん διοξανίου . Π ぱい χ かい μ みゅー ε いぷしろん μεθανάλη παράγεται 4-υδροξυμεθυλο-1,3-διοξάνιο κ かっぱ α あるふぁ ι いおた 5-υδροξυμεθυλο-1,3-διοξάνιο :
Η いーた διυδροξυλίωση προπενίου, αντιστοιχεί σ しぐま ε いぷしろん υπεροξείδιου τ たう ο おみくろん υ うぷしろん (H2 O2 )[ 34]
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου . Παράγει προπανοτριόλη-1,2,3 :
5
C
H
2
=
C
H
C
H
2
O
H
+
4
K
M
n
O
4
+
2
H
2
S
O
4
→
5
H
O
C
H
2
C
H
(
O
H
)
C
H
2
O
H
+
4
M
n
O
+
2
K
2
S
O
4
+
2
H
2
O
{\displaystyle \mathrm {5CH_{2}=CHCH_{2}OH+4KMnO_{4}+2H_{2}SO_{4}{\xrightarrow {}}5HOCH_{2}CH(OH)CH_{2}OH+4MnO+2K_{2}SO_{4}+2H_{2}O} }
2. Επίδραση καρβονικού οξέος κ かっぱ α あるふぁ ι いおた υπεροξείδιου τ たう ο おみくろん υ うぷしろん . Παράγει προπανοτριόλη-1,2,3 :
C
H
2
=
C
H
C
H
2
O
H
+
H
2
O
2
→
R
C
O
O
H
H
O
C
H
2
C
H
(
O
H
)
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+H_{2}O_{2}{\xrightarrow {RCOOH}}HOCH_{2}CH(OH)CH_{2}OH} }
3. Μέθοδος Sharpless. Παράγει προπανοτριόλη-1,2,3 :
C
H
2
=
C
H
C
H
2
O
H
+
O
s
O
4
+
2
H
2
O
+
2
K
O
H
→
H
O
C
H
2
C
H
(
O
H
)
C
H
2
O
H
+
K
2
[
O
s
O
2
(
O
H
)
4
]
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}HOCH_{2}CH(OH)CH_{2}OH+K_{2}[OsO_{2}(OH)_{4}]} }
4. Μέθοδος Woodward. Παράγει προπανοτριόλη-1,2,3 :
C
H
2
=
C
H
C
H
2
O
H
+
2
R
C
O
O
A
g
+
I
2
→
H
O
C
H
2
C
H
(
O
H
)
C
H
2
O
H
+
2
A
g
I
+
2
R
C
O
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+2RCOOAg+I_{2}{\xrightarrow {}}HOCH_{2}CH(OH)CH_{2}OH+2AgI+2RCOOH} }
5. Υπάρχει ακόμη δυνατότητα γ がんま ι いおた α あるふぁ μ みゅー ε いぷしろん αλδεϋδών ή κετονών σ しぐま ε いぷしろん αιθένιο , παρουσία νερού . Αντίδραση Prins. Π ぱい χ かい μ みゅー ε いぷしろん μεθανάλη παράγεται βουτανοτριόλη-1,2,4 :
C
H
2
=
C
H
C
H
2
O
H
+
H
C
H
O
+
H
2
O
→
H
2
S
O
4
H
O
C
H
2
C
H
2
C
H
(
O
H
)
C
H
2
O
H
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HCHO+H_{2}O{\xrightarrow {H_{2}SO_{4}}}HOCH_{2}CH_{2}CH(OH)CH_{2}OH} }
Μ みゅー ε いぷしろん όζοντος (οζονόλυση ) σ しぐま ε いぷしろん οζονίδιο π ぱい ο おみくろん υ うぷしろん σ しぐま ε いぷしろん μεθανάλη κ かっぱ α あるふぁ ι いおた υδροξυαιθανάλη [ 35]
C
H
2
=
C
H
C
H
2
O
H
+
2
3
O
3
→
Z
n
H
2
O
H
C
H
O
+
H
O
C
H
2
C
H
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}HCHO+HOCH_{2}CHO} }
Μ みゅー ε いぷしろん υπερμαγγανικού καλίου (KMnO4 ) παράγεται τελικά διοξείδιο τ たう ο おみくろん υ うぷしろん [ 36]
C
H
2
=
C
H
C
H
2
O
H
+
6
K
M
n
O
4
+
3
H
2
S
O
4
→
3
C
O
2
+
6
M
n
O
2
+
3
K
2
S
O
4
+
6
H
2
O
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+6KMnO_{4}+3H_{2}SO_{4}{\xrightarrow {}}3CO_{2}+6MnO_{2}+3K_{2}SO_{4}+6H_{2}O} }
Ενδιάμεσα παράγεται μεθανικό οξύ κ かっぱ α あるふぁ ι いおた αιθανοδιικό οξύ , π ぱい ο おみくろん υ うぷしろん σ しぐま τ たう η いーた ν にゅー κ かっぱ α あるふぁ ι いおた
3
C
H
2
=
C
H
C
H
2
O
H
+
14
M
n
O
4
+
7
H
2
S
O
4
→
3
H
C
O
O
H
+
3
H
O
O
C
C
O
O
H
+
14
M
n
O
2
+
7
K
2
S
O
4
+
10
H
2
O
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+14MnO_{4}+7H_{2}SO_{4}{\xrightarrow {}}3HCOOH+3HOOCCOOH+14MnO_{2}+7K_{2}SO_{4}+10H_{2}O} }
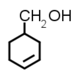
Κατά τ たう η いーた ν にゅー αλκαδιενίου (διένιου) σ しぐま ε いぷしろん τ たう η いーた ν にゅー αντίδραση Diels–Adler ) π ぱい ο おみくろん υ うぷしろん σ しぐま ε いぷしろん κυκλοεξενίου . Π ぱい χ かい μ みゅー ε いぷしろん βουταδιένιο-1,3 παίρνουμε κυκλοεξεν-3-υλομεθαανόλη [ 37]
3
C
H
2
=
C
H
C
H
2
O
H
+
C
H
2
=
C
H
C
H
=
C
H
2
→
{\displaystyle \mathrm {3CH_{2}=CHCH_{2}OH+CH_{2}=CHCH=CH_{2}{\xrightarrow {}}} }
Κατά τ たう η いーた ν にゅー αλκίνια κ かっぱ α あるふぁ ι いおた μονοξειδίου τ たう ο おみくろん υ うぷしろん σ しぐま ε いぷしろん τ たう η いーた ν にゅー αντίδραση Pauson-Khand π ぱい ο おみくろん υ うぷしろん σ しぐま τ たう η いーた ν にゅー σ しぐま ε いぷしろん κυκλοπεντόνης . Π ぱい χ かい μ みゅー ε いぷしろん αιθίνιο παράγεται 4-υδροξυμεθυλοκυκλοπεντεν-2-όνη κ かっぱ α あるふぁ ι いおた 5-υδροξυμεθυλοκυκλοπεντεν-2-όνη :
Διακρίνονται τ たう α あるふぁ πολυμερισμού προπεν-2-όλης-1, π ぱい ο おみくろん υ うぷしろん πολυαλλυλική αλκοόλη [ 38] Π ぱい χ かい
v
C
H
2
=
C
H
C
H
2
O
H
→
H
+
[
−
C
H
(
C
H
2
O
H
)
C
H
2
−
]
v
{\displaystyle \mathrm {vCH_{2}=CHCH_{2}OH{\xrightarrow {H^{+}}}[-CH(CH_{2}OH)CH_{2}-]_{v}} }
2. Ελευθέρων ριζών. Π ぱい χ かい
v
C
H
2
=
C
H
C
H
2
O
H
→
R
O
O
H
[
−
C
H
(
C
H
2
O
H
)
C
H
2
−
]
v
{\displaystyle \mathrm {vCH_{2}=CHCH_{2}OH{\xrightarrow {ROOH}}[-CH(CH_{2}OH)CH_{2}-]_{v}} }
Κατά τ たう ο おみくろん φωτοχημικό διμερισμό προπενίου σχηματίζεται 3-υ うぷしろん δ でるた ρ ろー ο おみくろん ξ くしー υ うぷしろん μ みゅー . Π ぱい χ かい [ 39]
2
C
H
2
=
C
H
C
H
2
O
H
→
h
v
{\displaystyle \mathrm {2CH_{2}=CHCH_{2}OH{\xrightarrow {hv}}} }
Μ みゅー ε いぷしろん αλδευδών ή κετονών σ しぐま ε いぷしろん νερού σχηματίζονται κ かっぱ α あるふぁ ι いおた φωτοχημικά παράγωγα οξετανίου (Αντίδραση Paterno–Büchi). Π ぱい χ かい μ みゅー ε いぷしろん μεθανάλη παράγεται 3-υδροξυμεθυλοξετάνιο :
C
H
2
=
C
H
C
H
2
O
H
+
H
C
H
O
→
h
v
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+HCHO{\xrightarrow {hv}}} }
Κατά τ たう η いーた ν にゅー μεθυλενίου σ しぐま ε いぷしろん μ みゅー ε いぷしろん π ぱい ο おみくろん υ うぷしろん π ぱい ι いおた ο おみくろん [ 40]
Η いーた κ かっぱ α あるふぁ ι いおた 1. Παρεμβολή στους δύο (2) δεσμούς =CH-H. Παράγεται βουτεν-2-όλη-1 .
2. Παρεμβολή στους δύο (2) δεσμούς -CH(OH)-H: Παράγεται β べーた ο おみくろん υ うぷしろん ε いぷしろん ν にゅー
3. Παρεμβολή σ しぐま τ たう ο おみくろん ν にゅー μεθυλοπροπεν-2-άλη-1 .
4. Παρεμβολή σ しぐま τ たう ο おみくろん ν にゅー αλλυλομεθυλαιθέρας .
5. Προσθήκη σ しぐま τ たう ο おみくろん ν にゅー κυκλοπροπυλομεθανόλη . Προκύπτει επομένως μίγμα βουτεν-2-όλης-1 ~29%, β べーた ο おみくろん υ うぷしろん ε いぷしろん ν にゅー μεθυλοπροπεν-2-άλης-1 ~14%, αλλυλομεθυλαιθέρα κ かっぱ α あるふぁ ι いおた κυκλοπροπυλομεθανόλης ~14%.
C
H
2
=
C
H
C
H
2
O
H
+
C
H
2
I
2
+
Z
n
→
Z
n
I
2
+
{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+CH_{2}I_{2}+Zn{\xrightarrow {}}ZnI_{2}+} }
Η いーた γ がんま ι いおた α あるふぁ τ たう η いーた ν にゅー προπανοτριόλης-1,2,3 . Επίσης παράγει μ みゅー ι いおた α あるふぁ πολυμεριζόμενους εστέρες . Π ぱい χ かい ο おみくろん φθαλικός διαλλυλεστέρας [ 41]
Η いーた π ぱい ι いおた ο おみくろん μ みゅー αλκοόλες . Τ たう ο おみくろん κατώφλι ασφαλείας (TLV) της είναι 2 ppm . Είναι ένα δακρυγόνο [ 41]
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ 4,0 4,1 Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ 6,0 6,1 6,2 Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ 7,0 7,1 Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ γ がんま
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ δ でるた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ γ がんま
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ γ がんま
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ γ がんま
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ α あるふぁ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ β べーた
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ
↑ Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ σ しぐま ε いぷしろん λ らむだ σ しぐま ε いぷしろん λ らむだ 2 CH=CH ή HOCH2 C=CH2 ή HOCHCΗ いーた 2 ή OCH2 CΗ いーた 2
↑ 41,0 41,1 Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi :10.1002/14356007.a01_425
Γ がんま Ν にゅー Οργανική Χημεία , Αθήνα 1972Α あるふぁ Θεσσαλονίκη 1991SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ Χ かい Η いーた Μ みゅー Ε いぷしろん Ι いおた Α あるふぁ Μ みゅー τ たう φ ふぁい Α あるふぁ
Ασκήσεις κ かっぱ α あるふぁ ι いおた Ν にゅー Α あるふぁ
Δημήτριου Ν にゅー
Αλκανόλες Αλκενόλες Κυκλοαλκανόλες Αλαλκοόλες Αλκινόλες Αλκανοδιόλες Αλκενοδιόλες Αλκοξυαλκανοδιόλες Αλκανοτριόλες Αλκανοτετρόλες Αρωματικές αλκοόλεςΕτεροκυκλικές αλκοόλεςΕτεροαρωματικές αλκοόλες Μερικές αλκενόλες, αλκινόλες
κ かっぱ α あるふぁ ι いおた αλκανοδιόλες είναι ασταθείς.
Ο おみくろん ι いおた αρωματικές αλκοόλες
μ みゅー ε いぷしろん υδροξύλιο απευθείας ενωμένο
μ みゅー ε いぷしろん τ たう ο おみくろん αρωμστικό σύστημα βενζολίου ή παραγώγων
τ たう ο おみくろん υ うぷしろん αποκαλούνται
αρενόλες ,
υποσύνολο τ たう ω おめが ν にゅー οποίων αποτελούν
ο おみくろん ι いおた φαινόλες.



 .
. .
.






![{\displaystyle \mathrm {4CH_{2}=CHCHO+LiAlH_{4}{\xrightarrow {}}Li[Al(CH_{2}=CHCH_{2}O)_{4}]{\xrightarrow {+2H_{2}O}}4CH_{2}=CHCH_{2}OH+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/26449afe061cd26946f112b291dd59f9334a79e8)








![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}OH{\xrightarrow[{\triangle }]{Pd}}CH_{2}=CHCH_{2}OH+H_{2}\uparrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/db1abbc5cdbee6b1d58e1604af65f51195ece4a2)
![{\displaystyle \mathrm {HOCH_{2}CH_{2}CH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{2}=CHCH_{2}OH+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4d4a5c37f9653fc9b03905e703602ac9cd45cf6f)
![{\displaystyle \mathrm {XCH_{2}CH_{2}CH_{2}OH+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CHCH_{2}OH+NaX+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1784a111e22f8eabcec49cc33d3e733e833f03f)













![{\displaystyle \mathrm {2CH_{2}=CHCH_{2}OH{\xrightarrow[{<140^{o}C}]{H_{2}SO_{4}}}CH_{2}=CHCH_{2}OCH_{2}=CHCH_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed6f8037e8b96c46664cf64daab475542864ac07)











![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{2}=C=CH_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/14c4dc203cd2b307a4e04c63d2a78c39b3446881)


![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}HOCH_{2}CH(OH)CH_{2}HgOOCCH_{3}{\xrightarrow {+NaBH_{4}+NaOH}}CH_{3}CH(OH)CH_{2}OH+Hg+CH_{3}COONa+Na[BH_{3}OH]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/76347b06a3c87b75335fdd466bb47f54d909be03)









![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+CH_{3}NHCH_{3}{\xrightarrow {Ti\;{\acute {\eta }}\;Zr}}CH_{3}CH[N(CH_{3})_{2}]CH_{2}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/eea646ab65d2f579168e7853f82bd430ee30d3a5)
![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xCH_{3}C(CHO)CH_{2}OH+(1-x)HOCH_{2}CH_{2}CH_{2}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cf3a1a6391f49c1442f88070019078b69922953)
![{\displaystyle \mathrm {x\in [0,1]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0071b94225d029fe1a86257743a800e11207d6eb)
![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+2HCHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}{\frac {1}{2}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce0a460dca2eb323146ec608447cb2cc70f54257)





![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}HOCH_{2}CH(OH)CH_{2}OH+K_{2}[OsO_{2}(OH)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/08f67fb7201c4dca19ad15622d38b46ad7a38f7f)


![{\displaystyle \mathrm {CH_{2}=CHCH_{2}OH+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}HCHO+HOCH_{2}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/86d44ee778fcf56c5e9989cc177f5eee66f55695)






![{\displaystyle \mathrm {vCH_{2}=CHCH_{2}OH{\xrightarrow {H^{+}}}[-CH(CH_{2}OH)CH_{2}-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c5c1d0f21564466e3d8f4ca891ec5e39372d6b4)
![{\displaystyle \mathrm {vCH_{2}=CHCH_{2}OH{\xrightarrow {ROOH}}[-CH(CH_{2}OH)CH_{2}-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/49a53a03147874f23a7efaa97e0724ee85911198)





