Amino
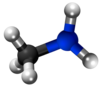
Aminoj estas derivaĵoj de amoniako en kiuj unu aŭ pli el la tri hidrogenatomoj estas anstataŭigitaj per alkilaj aŭ arilaj grupoj. La anstataŭigo de unu hidrogenatomo per unu alkila aŭ arila grupo produktas primarajn aminojn; de du hidrogenaj atomoj kun du grupoj al sekundaraj aminoj, de tri hidrogenaj atomoj kun tri grupoj al terciaraj aminoj. La terciaraj aminoj posedas la potencon kombini kun unu molekula proporcio de alkiljodido por formi kvaternarajn amoniajn salojn. La strukturaj rilatoj de tiuj kunmetaĵoj povas esti montritaj laŭ la flanka kadro.
| Tipoj de aminoj | |
 |
Amoniako |
 |
Primara amino |
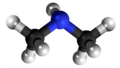 |
Sekundara amino |
 |
Terciara amino |
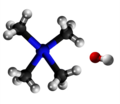 |
Kvaternara amonia hidroksido |
Amino laŭdire estas alifata se ĉiu karbonatomo kiu estas kunigita rekte al la amina nitrogeno estas saturita. Ĉi tio validas eĉ se aromaj ringoj ĉeestas en pli malproksimaj partoj de la molekulo. La komponaĵoj de ĉi tiu tipo posedas ecojn tre similajn al tiuj de amoniako. La plej malsupraj membroj de la serio estas bruligeblaj gasoj kaj estas facile solveblaj en akvo.
La venontaj pli altaj membroj de la serio estas likvaĵoj kun malalta bolpunkto kaj ankaŭ estas solvebla en akvo, la solvebleco kaj volatileco, aliflanke, malpliiĝas kun la kreskanta karbonenhavo de la molekulo. La plej altaj membroj de la serio estas senodoraj solidoj kun alta bolpunkto kaj estas nesolveblaj en akvo. Ili ĉiuj estas modere fortaj bazoj, facile formante salojn kun la mineralaj acidoj.
Ili estas jonigitaj en akva solvaĵo laŭ iom pli granda forto ol amoniako. La kvaternaraj amoniaj bazoj, NR4-OH, distinge de la aminoj, estas solidaĵoj kiuj estas solveblaj en akvo; ili estas multe pli forte bazaj ol amoniako aŭ iu ajn el la aminoj, kaj, fakte, estas kompareblaj en forto al la natriaj kaj kaliaj hidroksidoj.
Multaj metodoj estis elpensitaj por la preparado de primaraj aminoj. Metilamino estis izolita en 1849 fare de Charles-Adolphe Wurtz (1817-1884) dum bolado de metilizocianato kun kalia hidroksido. Laŭ la sekva reakcio:
Pliaj metodoj de preparado inkluzivas la reduktigon de nitriloj kun alkoholo kaj natrio; la hidrolizo de alkilftalimidoj - 1887, Sintezo de Siegmund Gabriel (1851-1924) -, kaj la ago de bromo aŭ kloro kaj forta bazo sur la aminoj de karboksilacidoj (von Hoffmann, 1882 ). La sekundaraj aminoj estas preparataj, kune kun la primaraj kaj terciaraj, per la ago de amoniako sur la alkiljodidoj kaj ankaŭ laŭ multaj aliaj manieroj.


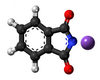
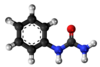
Per la agado de amoniako sur la alkiljodidoj estas akirita kompleksa miksaĵo de primaraj, sekundaraj kaj terciaraj aminoj, kune kun kvaternaraj amoniaj saloj, kies apartigo estas malfacila. Metodo estis ellaborita fare de von Hoffmann en 1850 por la etilaminoj sed ne estis vaste disvastigita. Pli ĝenerala metodo elpensita en 1890 de Oscar Hinsberg (1857-1939) konsistas en traktado de la miksbazoj kun benzensulfonilklorido (aŭ p-tolueno-sulfonila klorido)[1]. La primara bazo donas acidan derivaĵon, (Vidu bildon 1, N-metil-p-toluenosulfonamido), solveblan en akva alkalo, la sekundara bazo provizas la kunmetaĵon (Vidu bildon 2, N,N-Dumetil-p-toluenosulfonamido), nesolveblan en alkalo, dum la terciara bazo ne reagas. La procezo estas aplikebla kaj al alifataj kaj al aromataj aminoj.
Kiam la aminogrupo prioritatas, la molekulan nomon finas sufikso "-amino". Kontraŭe ĝi havas prefikson "amino-"
Sintezoj
[redakti | redakti fonton]Klasike, la aminoj estas kreataj de alkilado el malaltarangaj aminoj. Per alkilado de amoniako ekestas unuarangaj aminoj, kiujn poste oni povas alkiladi en dua- kaj triarangajn aminojn. La alkilado de triarangaj aminoj fordonas salojn de kvarrangaj aminoj.
Ekzistas aliaj metodoj:
- La unuarangajn aminojn oni povas estigi per redukto de azidogrupo;
- Ankaŭ la aminojn povas fordoni la redukto de amido per hidrido;
- La redukta aminado ebligas la kreadon de aminoj kun flankaj grupoj, el karbonaj kombinaĵoj, (aldehidoj aŭ ketonoj).
Sintezo 1
[redakti | redakti fonton]- Sintezo de aminoj per traktado de alkoholo kun amoniako:
Tamen, se ni uzas du molarojn da amino, la fina produkto estas sekundara amino:
Sekve, se ni uzas tri molarojn da amino, la fina produkto estas terciara amino:
Sintezo 2
[redakti | redakti fonton]- Preparado de aminoj per reduktado de nitrokombinaĵoj en ĉeesto de LiAlH4:
Sintezo 3
[redakti | redakti fonton]- Preparado per traktado de kloridoj kun amoniako:
Sintezo 4
[redakti | redakti fonton]- Sintezo de Gabriel: Reakcio inter klorido kaj ftalimido donante kiel flankprodukton kalian ftalaton kaj KBr:
Sintezo 5
[redakti | redakti fonton]- Per hidratigo de izocianatoj:
Sintezo 6
[redakti | redakti fonton]- Hidrolizo de ureoj en alkala medio:
Sintezo 7
[redakti | redakti fonton]- Rearanĝo de Hofmann: Temas pri reakcio inter primara amido kaj natria hipobromito:
Sintezo 8
[redakti | redakti fonton]- Rearanĝo de Curtius: Kreita en 1885, ĉi-reakcio estas simila al la Rearanĝo de Hofmann, tamen la reakciaĵoj estas amido kaj nitrita acido:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Kun nitrozila klorido primaraj aminoj donas alkilan kloridon:
Reakcio 2
[redakti | redakti fonton]- Kun sekundaraj amino, nitrozila klorido donas nitrozaminojn:
Reakcio 3
[redakti | redakti fonton]- Kun karbonila klorido, aminoj donas izocianatojn:
Reakcio 4
[redakti | redakti fonton]- Aminoj reakcias kun fenilaj izocianatoj por doni substitutitan ureon, kiuj estas kristalaj kaj taŭgas por karakterizi la aminojn:
Reakcio 5
[redakti | redakti fonton]- Kun acetila klorido aminoj formas amidon:
Reakcio 6
[redakti | redakti fonton]- Kun acetata anhidrido aminoj formas amidon kaj la respektivan karboksilatan acidon:
Reakcio 7
[redakti | redakti fonton]- Karbilamina reakcio: Ankaŭ konata kiel "Sintezo de Hoffman isocianido", temas pri interagado de primara amino, kloroformo kaj bazo:
Reakcio 8
[redakti | redakti fonton]- Testo de la mustardoleo de Hoffman: Tiu eksperimento taŭgas por diferencigi primarajn aminojn elde sekundaraj aminoj. Oni devas agnoski ke la izotiocianatoj havas mustardosimilan odoron:
Ecoj
[redakti | redakti fonton]La nitrogena atomo de aminoj enhavas solan elektronan paron. Tio igas la aminojn bazajn kaj nukleofilajn. Ĉe unua- kaj duarangaj aminoj, la ligo N-H povas rompiĝi, tial igante ilin iom acidajn.
| Fizika tabelo de la aminoj | ||||||
| Formulo | [[Fandopunkto|Fp ( °C)]] | [[Bolpunkto|Bp ( °C)]] | Specifa maso | nD | pKb | |
| CH5N | … | 10.63 | ||||
| C2H7N | … | 10.68 | ||||
| C3H9N | 1.364 | 9.80 | ||||
| C2H7N | 1.384 | 10.81 | ||||
| C4H11N | 1.386 | 11.02 | ||||
| C6H15N | 1.401 | 10.75 | ||||
| C3H9N | 1.388 | 10.60 | ||||
| C6H15N | 1.405 | 10.93 | ||||
| C9H21N | 1.417 | 10.46 | ||||
| C8H19N | 1.415 | 11.25 | ||||
| C12H27N | 1.428 | … | ||||
| C5H13N | 1.411 | 10.63 | ||||
| C10H23N | 1.427 | … | ||||
| C15H33N | 1.437 | … | ||||
| C6H15N | 1.418 | 10.56 | ||||
| C12H27N | 1.434 | … | ||||
| C18H39N | 1.442 | … | ||||
| C7H17N | 1.422 | 10.67 | ||||
| C14H31N | … | … | ||||
| C8H19N | 1.429 | 10.65 | ||||
| C16H35N | 1.443 | … | ||||
| C24H51N | 1.449 | … | ||||
| C9H21N | 1.433 | 10.64 | ||||
| C10H23N | 1.437 | 10.64 | ||||
| C20H43N | 1.4552 | … | ||||
| C13H29N | 1.4457 | … | ||||
| C11H25N | 1.4415 | … | ||||
| C12H27N | … | … | ||||
| C24H51N | 1.4641 | … | ||||
| C36H75N | 1.458 | … | ||||
| C39H81N | 1.4771 | … | ||||
| C14H31N | 1.5045 | … | ||||
| C15H33N | 1.4991 | … | ||||
| C16H35N | 1.450 | … | ||||
| C18H39N | … | … | ||||
| C36H75N | 1.4841 | … | ||||
Ciklaj aminoj
[redakti | redakti fonton]| Fizika tabelo de la ciklaminoj | ||||||
g/ml |
°C |
°C |
temperaturo °C |
indico | ||
Aromataj aminoj
[redakti | redakti fonton]| Fizika tabelo de la aromataminoj | ||||||
g/ml |
°C |
°C |
temperaturo °C |
Indico | ||
Aminoj
[redakti | redakti fonton]- Anizilamino
- Butilamino
- Furfurilamino
- Heksilamino
- Heptilamino
- Izobutilamino
- Miristilamino
- Neopentilamino
- Pentilamino
Organikaj komponaĵoj
[redakti | redakti fonton]Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ Kiam la amina grupo (NH2) ligiĝas al l sulfonila grupo (SO2) tiam ĝi konatas kiel sulfamido.
| ||||



![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)

![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{LiAlH_{4}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7663c37c9a24e207e64cd3932d04346894c67fb0)

![{\displaystyle {\mathsf {{\xrightarrow[{-KBr}]{+2\,KOH}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e1922842a9aba4464dbd87a2ac89f0a62334abf)



![{\displaystyle {\mathsf {{\xrightarrow[{-H_{2}O}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f43b576bd9ed502188c0c051352bf946467a579c)




![{\displaystyle {\mathsf {{\xrightarrow[{-HgS}]{+HgCl_{2}}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b9c90515e457808d6d19f695d5ff30b7a616d6c)