Trietilendiamina
| Trietilendiamina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,4-diazabiciclo[2.2.2]octano | ||
| General | ||
| Otros nombres |
DABCO 1,4-etilenpiperazina TEDA TED | |
| Fórmula molecular | C6H12N2 | |
| Identificadores | ||
| Número CAS | 280-57-9[1] | |
| Número RTECS | HM0354200 | |
| ChEMBL | CHEMBL3183414 | |
| ChemSpider | 8882 | |
| PubChem | 9237 | |
| UNII | X8M57R0JS5 | |
|
C1CN2CCN1CC2
| ||
| Propiedades físicas | ||
| Apariencia | Sólido. Cristales o polvo incoloro o blanco. | |
| Olor | Amoniacal. | |
| Densidad | 1140 kg/m³; 1,14 g/cm³ | |
| Masa molar | 11 217 g/mol | |
| Punto de fusión | 158 °C (431 K) | |
| Punto de ebullición | 174 °C (447 K) | |
| Presión de vapor | 0,74 mmHg | |
| Índice de refracción (nD) | 1,4634 | |
| Propiedades químicas | ||
| Acidez | 3,0 / 8,7 pKa | |
| Solubilidad en agua | 450 g/L | |
| Solubilidad | 770 g/L (en etanol) | |
| log P | -0,49 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 335,15 K (62 °C) | |
| Temperatura de autoignición | 623,15 K (350 °C) | |
| Compuestos relacionados | ||
| aminas no heterocíclicas |
Ciclohexanamina 1,4-ciclohexanodiamina | |
| aminas heterocíclicas |
Piperidina 1,4-dimetilpiperazina Azocano | |
| tetraminas heterocíclicas | Hexametilentetramina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La trietilendiamina es un compuesto orgánico heterocíclico cuya fórmula es N2(C2H4)3. Es una diamina bicíclica con ambos grupos amino terciarios. También es conocida como DABCO, 1,4-etilenpiperazina y TEDA.[2] El término DABCO, muy difundido, es una marca comercial registrada y es una abreviatura de la nomenclatura IUPAC de este compuesto: 1,4-diazabiciclo[2.2.2]octano.
Propiedades físicas y químicas
[editar]A temperatura ambiente, la trietilendiamina es un sólido con una densidad de 1,14 g/L. Su aspecto es el de polvo o cristales incoloros o blanquecinos, con un cierto aroma amoniacal. Su punto de fusión es de 158 °C y su punto de ebullición 174 °C. Es una sustancia soluble en acetona (130 g/L), agua (450 g/L), benceno (510 g/L) y etanol (770 g/L). El valor del logaritmo de su coeficiente de reparto, logP = -0,49, indica que su solubilidad es algo mayor en disolventes polares que en apolares.[2][3][4]
En cuanto a reactividad, la trietilendiamina es una sustancia higroscópica. Es incompatible con oxidantes fuertes y peróxidos —véase más abajo—, así como con ácidos fuertes.[5]
Síntesis
[editar]La trietilendiamina se produce por reacciones térmicas de compuestos del tipo H2NCH2CH2X (donde X = OH, NH2 o NHR) en presencia de catalizadores de zeolita. Así, se puede sintetizar a partir de la tetraetilenpentamina —que a su vez se elabora desde la trietilentetramina o la dietilentriamina—[4] o de le etilendiamina, de acuerdo a la reacción:[6]
Usos
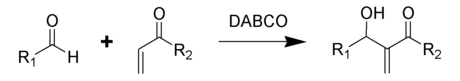
[editar]La trietilendiamina es notablemente nucleófila, utilizándose como catalizador y reactivo en polimerización y síntesis orgánica.[7] Se emplea como catalizador básico para la formación de poliuretano a partir de aminas e isocianatos,[8] así como en reacciones de Baylis-Hillman entre aldehídos y compuestos orgánicos insaturados:[9]
Al ser por su estructura una amina «sin obstáculos», constituye un ligando fuerte y una base de Lewis. Forma un aducto cristalino 2:1 con peróxido de hidrógeno[10] y dióxido de azufre.[11]
Por otra parte, este compuesto puede usarse para alargar la vida de los tintes. Esto hace que sea útil en láseres de tinte y en el montaje de muestras para microscopia de fluorescencia (cuando se usa conjuntamente con glicerol y PBS).[12]
Precauciones
[editar]Esta es una sustancia inflamable cuyo polvo puede formar mezclas explosivas con el aire. Al arder puede desprender productos nocivos como óxidos de nitrógeno y monóxido de carbono; su descomposición térmica también puede generar gases y vapores irritantes. El punto de inflamabilidad de la trietilendiamina es 62 °C y su temperatura de autoignición es de 350 °C.[5]
Este compuesto resulta irritante para ojos y piel. La inhalación de concentraciones altas de su vapor puede originar dolor de cabeza, mareos, cansancio, náuseas y vómitos.[5]
Véase también
[editar]Los siguientes compuestos son isómeros de la trietilendiamina:
Las siguientes aminas derivan de cicloalcanos:
Referencias
[editar]- ↑ Número CAS
- ↑ a b Triethylenediamine (PubChem)
- ↑ DABCO (ChemSpider)
- ↑ a b Triethylenediamine (Chemical Book)
- ↑ a b c Triethulenediamine (Acros)
- ↑ Process for the preparation of triethylenediamine and piperazine (1991). Jens Prof. Dr. Weitkamp, Stefan Dr. Ernst, Dieter Lindner, Hans-Josef Dr. Buysch, Artur Dr. Botta, Lothar Dr. Puppe. Patente EP 0423526 A3.
- ↑ Uppuluri V. Mallavadhani, Nicolas Fleury-Bregeot. "1,4-Diazabicyclo [2.2.2]octane". In Encyclopedia of Reagents for Organic Synthesis, 2010, John Wiley & Sons, Ltd. doi 10.1002/047084289X.rd010m.pub2
- ↑ «Polyurethane additives guide». Air Products & Chemicals. Archivado desde el original el 18 de mayo de 2015.
- ↑ Baylis, A. B.; Hillman, M. E. D. German Patent 2155113, 1972.
- ↑ P. Dembech, A. Ricci, G. Seconi, and M. Taddei "Bis(trimethylsilyl) Peroxide" Org. Synth. 1997, volume 74, pp. 84. doi 10.15227/orgsyn.074.0084
- ↑ Ludovic Martial and Laurent Bischoff "Preparation of DABSO from Karl-Fischer Reagent" Org. Synth. 2013, volume 90, pp. 301. doi 10.15227/orgsyn.090.0301
- ↑ Valnes, K.; Brandtzaeg, P. (1985). «Retardation of immunofluorescence fading during microscopy» (pdf). Journal of Histochemistry and Cytochemistry 33 (8): 755-761. PMID 3926864.