Karbono tetrakloruro
| Karbono tetrakloruro | |
|---|---|
 | |
 | |
| Formula kimikoa | CCl4 |
| SMILES kanonikoa | 2D eredua |
| MolView | 3D eredua |
| Konposizioa | karbono eta kloro |
| Mota | halon (en) |
| Ezaugarriak | |
| Dentsitatea | 1,59 g/cm³ (20 °C, likido) |
| Soinuaren abiadura | 930 m/s (25 °C, likido) |
| Errefrakzio indiziea | 1,4607 |
| Disolbagarritasuna | 0,05 g/100 g (ur, 20 °C) 0,8 g/L (ur, 20 °C) |
| Momentu dipolarra | 0 D |
| Fusio-puntua | −23 °C −22,6 °C −23 °C |
| Irakite-puntua | 77 °C (760 Torr) 76,8 °C (101,325 kPa) |
| Fusio-entalpia | 0 D |
| Lurrun-presioa | 91 mmHg (20 °C) 11,6 kPa (20 °C) |
| Ura-oktanol banatze kofizientea | 2,64 |
| Gainazal-tentsioa | 26,43 mN/m (25 °C) |
| Masa molekularra | 151,87541072 Da |
| Erabilera | |
| Rola | occupational carcinogen (en) |
| Arriskuak | |
| NFPA 704 | |
| Denboran ponderatutako esposizio muga | 62,9 mg/m³ (8 h, Ameriketako Estatu Batuak) |
| Denbora laburreko esposizio muga | 12,6 mg/m³ (baliorik ez) |
| Gehienezko esposizio muga | 200 mg/m³ (Ameriketako Estatu Batuak) |
| Esposizioaren goiko muga | 25 mg/m³ (Ameriketako Estatu Batuak) |
| IDLH | 1.258 mg/m³ |
| Berokuntza globalerako gaitasuna | 2.019 |
| Eragin dezake | carbon tetrachloride exposure (en) |
| Identifikatzaileak | |
| InChlKey | VZGDMQKNWNREIO-UHFFFAOYSA-N |
| CAS zenbakia | 56-23-5 |
| ChemSpider | 5730 |
| PubChem | 5943 |
| Reaxys | 1098295 |
| Gmelin | 27385 |
| ChEMBL | CHEMBL44814 |
| NBE zenbakia | 1846 |
| RTECS zenbakia | FG4900000 |
| ZVG | 1480 |
| DSSTox zenbakia | FG4900000 |
| EC zenbakia | 200-262-8 |
| ECHA | 100.000.239 |
| MeSH | D002251 |
| Human Metabolome Database | HMDB0031330 |
| UNII | CL2T97X0V0 |
| KEGG | C07561 |
Karbono tetrakloruroa, karbono(IV) kloruroa edo tetraklorometanoa CCl4 formulako konposatu organokloratua da. Usain gozoko likido kolorgea da eta tenperatura baxuetan ez da sukoia[1].
Erabilera ugari izan ditu hala nola disolbatzaile, su-itzaltzaile, hozgarrien aitzindari edo garbiketa-agente gisa. Bere toxikotasuna medio atzen hiruzpalau hamarkadetan baztertuz joan da bere erabilera orokortua.
Esposizio luzeak nerbio-sistemari, gibelari eta giltzurrunei eragiten die eta luzueegia bada heriotza ekar lezake[2][3].
Ezaugarriak
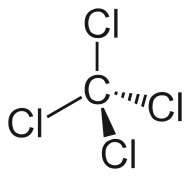
[aldatu | aldatu iturburu kodea]Karbono tetrakloruroaren molekulan kloro-atomoa tetraedro baten lau erpinetan kokatzen dira erdian karbono-atomoa dagoelarik, metanoan hidrogenoak kokatzen diren modu berean. Lotura kobalentez lotzen dira bost atomoak. Geometria horren ondorioz apolarra da.
Oso disolbatzaile egokia da olioen eta koipeen moduko substantzia apolarrak disolbatzeko. Iodoa ere disolbatzen du.
Uretan ez da disolbatzen eta hura baino dentsoagoa denez hondoratu egiten da beste fase likido bat eratuz.
Karbono tetrakloruroa, bestalde, ozono-geruza kaltetzen du eta berotegi-gasa da[4]. Atmosferan 85 urteko iraupena du deskonposatu aurretik. Arrazoi horiek medio Montrealgo protokoloak karbono tetrakloruroaren erabilera mugatu zuen[5].
Tenperatura handitan berotzean fosgenoa sortzen du.
Sintesia
[aldatu | aldatu iturburu kodea]Henri Victor Regnault-ek kimikari frantsesak sintetizatu zuen lehen aldiz 1839an kloroformoa kloroz tratatzean[6].
Egun metanoaren klorazioz sintetizatzen da eta, erreakzio-baldintzen arabera, sarri beste organokloratu batzuekin (klorometanoarekin diklorometanoarekin eta kloroformoarekin) nahastuta lortzen da. Kasu horretan destilazioz bereizten dira.
1950eko hamarkada baino lehen karbono tetrakloruroa karbono disulfuroa kloratuz sintetizatzen zen[7].
Erabilera
[aldatu | aldatu iturburu kodea]Historikoki prozesu askotan usatu da karbono tetrakloruroa.
Laborategian ohiko erabilerako disolbatzaileetako bat zen konposatu organikoekin lana egiten zenean. Egun nagusiki infragorrizko espektrozkopiako laginak prestatzeko erabiltzen da nagusiki, argi-espektroaren uhin-luzera horietan xurgatzen ez duelako[8]. Protoien erresonantzia magnetiko nuklearrezko espektroak egiteko disolbatzaile oso erabilia izan da karbono tetrakloruroak ez duelako hidrogenorik, baina egun disolbatzaile deuteratuak baliatzen dira nagusiki[9].
Hiru erabilera nagusi izan ditu industrian. Su-itzaltzaile moduan su likidoak zein elektrikoak itzaltzeko su-itzalgailuetan baliatu zen. Hozkailuetan erabiltzen ziren hoztaile fluoratuak, klorofluorohidrokarburoak alegia, sintetizatzeko aitzindarietako bat zen. Gordetako aleak zomorroez eta intsektuez babesteko karbono disulfuroarekin nahastuta, 20/80 proportzioan, fumigatzaile gisa baliatzen zen.
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ (Ingelesez) PubChem. «Carbon tetrachloride» pubchem.ncbi.nlm.nih.gov (Noiz kontsultatua: 2022-02-21).
- ↑ (Ingelesez) Seifert, Wilfried F.; Bosma, Anne; Brouwer, Adriaan; Hendriks, Henk F. J.; Roholl, Paul J. M.; Leeuwen, Rick E. W. van; Ruiter, G. Christa F. van Thiel-De; Seifert-Bock, Ingrid et al.. (1994). «Vitamin A deficiency potentiates carbon tetrachloride-induced liver fibrosis in rats» Hepatology 19 (1): 193–201. doi:. ISSN 1527-3350. (Noiz kontsultatua: 2022-02-21).
- ↑ (Ingelesez) «Carbon Tetrachloride Toxicity: What Are the Toxicological Effects of Carbon Tetrachloride Exposure? | Environmental Medicine | ATSDR» www.atsdr.cdc.gov 2021-02-09 (Noiz kontsultatua: 2022-02-21).
- ↑ Maider, Etxaide. (1998-02-01). «Disolbatzaile organikoen ordezkapena industrian» Zientzia.eus (Noiz kontsultatua: 2022-02-21).
- ↑ (Ingelesez) «Carbon Tetrachloride Toxicity: What Is Carbon Tetrachloride? | Environmental Medicine | ATSDR» www.atsdr.cdc.gov 2021-02-09 (Noiz kontsultatua: 2022-02-21).
- ↑ (Ingelesez) Regnault, V.. (1839). «Ueber die Chlorverbindungen des Kohlenstoffs, C2Cl2 und CCl2» Annalen der Pharmacie 30 (3): 350–352. doi:. ISSN 1099-0690. (Noiz kontsultatua: 2022-02-21).
- ↑ (Ingelesez) Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter et al.. (2006). «Chlorinated Hydrocarbons» Ullmann's Encyclopedia of Industrial Chemistry (John Wiley & Sons, Ltd) doi:. ISBN 978-3-527-30673-2. (Noiz kontsultatua: 2022-02-21).
- ↑ Arrasatea, Sonia & Anakabe,, Eneritz. (2009). Sintesi organikoa II. EHU, 11 or. ISBN 978-84-692-7054-7..
- ↑ Irazabalbeitia, Iñaki. (D.L. 1983). Erresonantzia magnetiko nuklearra : onarri teorikoa eta ariketak. Elhuyar ISBN 84-86158-20-6. PMC 434843063. (Noiz kontsultatua: 2022-02-22).



