ビリジン
| ビリジン | |
|---|---|

| |
(1S,2S,11bR)-1-Hydroxy-2-methoxy-11b-methyl-1,7,8,11b-tetrahydrocyclopenta[7,8]phenanthro[10,1-bc]furan-3,6,9(2H)-trione | |
| CAS |
3306-52-3 |
| ChemSpider | 85065 |
| |
| |
| C20H16O6 | |
| モル |
352.337 g mol?1 |
ビリジン(Viridin)は、Gliocladium virensの
生 合成
[ビリジンの
Gliocladium deliquescensによる、ビリジンの3
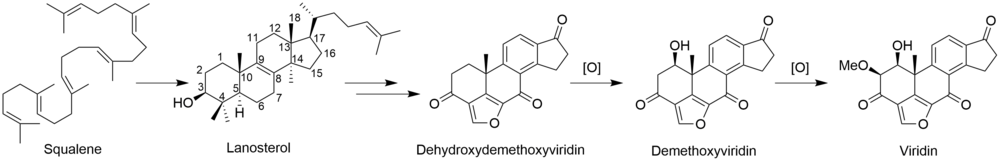
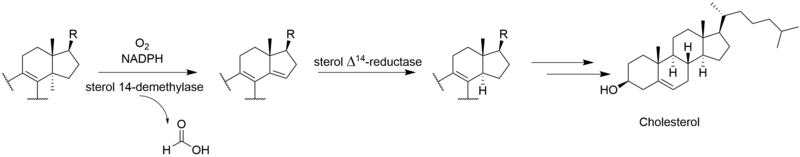
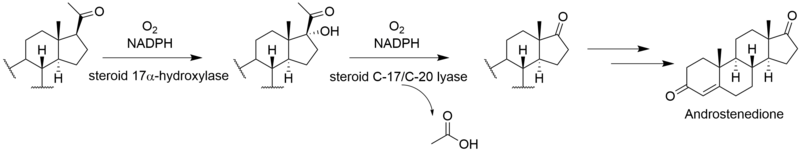
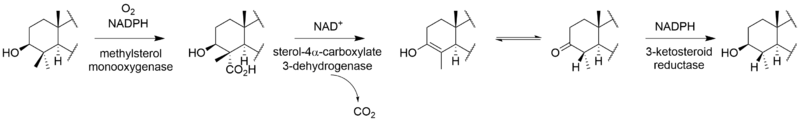
出典
[- ^ BRIAN, P. W.; MCGOWAN, J. G. (4 August 1945). “Viridin: a Highly Fungistatic Substance Produced by Trichoderma viride”. Nature 156 (3953): 144-145. doi:10.1038/156144a0.
- ^ Yano, H; Nakanishi, S; Kimura, K; Hanai, N; Saitoh, Y; Fukui, Y; Nonomura, Y; Matsuda, Y (Dec 5, 1993). “Inhibition of histamine secretion by wortmannin through the blockade of phosphatidylinositol 3-kinase in RBL-2H3 cells.”. The Journal of Biological Chemistry 268 (34): 25846-56. PMID 7503989.
- ^ Blight, Margaret M.; Coppen, J. J. W.; Grove, John Frederick. “The biogenesis, from mevalonic acid, of the steroidal antifungal metabolite viridin”. Chemical Communications (London) (18): 1117. doi:10.1039/C19680001117.
- ^ Golder, Walter S.; Watson, Thomas R.. “Lanosterol derivatives as precursors in the biosynthesis of viridin. Part 1”. Journal of the Chemical Society, Perkin Transactions 1: 422. doi:10.1039/P19800000422.
- ^ a b c Hanson, James R.; O'Leary, Margaret A.; Wadsworth, Harry J.. “Studies in terpenoid biosynthesis. Part 28. The acetate and mevalonate labelling patterns of the steroid, demethoxyviridin”. Journal of the Chemical Society, Perkin Transactions 1: 867. doi:10.1039/P19830000867.
- ^ a b Dewick, Paul M. (2009). Medicinal natural products : a biosynthetic approach (3rd ed.). Chichester: A John Wiley & Sons. ISBN 978-0-470-74167-2
- ^ Hanson, James R.; O'leary, Margaret A.; Wadsworth, Harry J.; boon, leng yeoh. “The biosynthesis of the steroid, viridiol, by Gliocladium deliquescens”. Phytochemistry 27 (2): 387?389. doi:10.1016/0031-9422(88)83104-2.
- ^ Jones, Richard (1987). “Conversion of viridin to viridiol by viridin-producing fungi.”. Canadian Journal of Microbiology 33 (11): 963-966. doi:10.1139/m87-169.
