Fenol
| Tomuto článku alebo sekcii chýbajú odkazy na spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešte overiť. Pomôžte Wikipédii a doplňte do článku citácie, odkazy na spoľahlivé zdroje. |
| Fenol | |||||||||||||||||||
 | |||||||||||||||||||
 | |||||||||||||||||||
 | |||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||
| Sumárny vzorec | Šablóna:ChemC6H6O | ||||||||||||||||||
| Systematický názov | Fenol | ||||||||||||||||||
| Synonymá | benzenol, hydroxybenzén, kyselina karbolová | ||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||
| Molárna hmotnosť | 94,113 g/mol | ||||||||||||||||||
| pKA | 9,95 (vo vode) | ||||||||||||||||||
| |||||||||||||||||||
| PubChem | 996 | ||||||||||||||||||
| ChemSpider | 971 | ||||||||||||||||||
| SMILES | Oc1ccccc1 | ||||||||||||||||||
| 3D model (JSmol) | Interaktívny 3D model | ||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||

Fenol alebo benzenol je hydroxyderivát benzénu. Je to tuhá bezfarebná kryštalická látka s charakteristickým zápachom. Na svetle a vzduchu postupne ružovie až hnedne a pôsobením kyslíka zvetráva. Fenol je najjednoduchším zástupcom skupiny aromatických hydroxyderivátov – fenolov.
Vlastnosti
[upraviť | upraviť zdroj]Fyzikálne
[upraviť | upraviť zdroj]Za normálnych podmienok tvorí fenol bezfarebné kryštály, ktoré majú niekedy tendenciu sa roztekať. Teplota topenia je 40,5 °C, teplota varu 181,7 °C a hustota 1070 kg/m3. Rozpustnosť fenolu vo vode je pomerne nízka, ale je možné ju zvýšiť prídavkom silnej zásady (napr. NaOH). Fenol je silné dezinficiens, ale pre svoj zápach a jedovatosť (LDLO = 140 mg/kg) sa už na tieto účely nepoužíva.
- Mólová hmotnosť: 94,11 g/mol
- pH = 4,9–5,5 (50 g fenolu/1 L vody)
- Dynamická viskozita: 3,437 mPa.s (pri 50 °C)
- Tlak nasýtených pár: 0,2 hPa (pri 20 °C)
- Medza výbušnosti: 1,3–9,5 obj. %
Chemické vlastnosti
[upraviť | upraviť zdroj]Fenol je z hľadiska Brønstedovej teórie slabá kyselina (pKa = 9,95), pretože vodík hydroxylovej skupiny je odštiepiteľný v podobe protónu. Zvýšenú kyslosť fenolu oproti jeho alifatickému analógu cyklohexanolu zapríčiňuje vysoká elektrónová hustota na aromatickom jadre.
Fenol poskytuje okrem elektrofilných substitučných reakcií na aromatickom jadre aj reakcie prebiehajúce na hydroxylovej skupine (napr. esterifikácia, tvorba alkalických fenolátov):
- C6H5OH + NaOH → C6H5ONa + H2O
Elektrofilné substitúcie prebiehajú na fenole ľahšie než na benzéne, pretože substituent –OH zvyšuje elektrónovú hustotu jadra, keďže nad záporným indukčným efektom prevláda kladný mezomérny efekt (+M efekt):
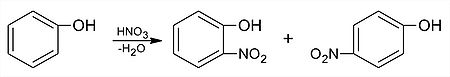
Výroba
[upraviť | upraviť zdroj]Fenol sa bežne nachádza v čienouhoľnom dechte a vo vypieracích vodách po karbonizácii čierneho uhlia. Tieto zdroje však zabezpečujú len malú časť svetovej produkcie fenolu (2,2 mil. ton ročne). Technologicky sú dobre zvládnuté viaceré metódy prípravy:
- alkalické tavenie kyseliny benzénsulfónovej
- hydrolýza chlórbenzénu
- kuménový proces.
Najpoužívanejšia metóda je kuménový proces (kumén = izopropylbenzén), pretože pri tomto spôsobe vzniká ako vedľajší produkt acetón.
Použitie
[upraviť | upraviť zdroj]Fenol má veľmi široké spektrum využitia. Najväčšia časť svetovej produkcie sa využíva na výrobu fenolformaldehydových živíc a




