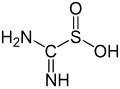
Sulfínová kyselina
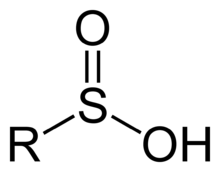
Sulfínové kyseliny sú organosírne zlúčeniny, ktoré obsahujú funkčnú skupinu RSO(OH).[1] Predstavujú medzikrok v oxidačných stupňoch organických zlúčenín síry, ktoré existujú od tiolov (-2) cez sulfénové kyseliny (+2) až po sulfónové kyseliny (+6).[2][3] Konjugované zásady sulfínových kyselín sa označujú ako sulfináty.
Nesubstituovaná kyselina sulfínová, kde R = H, je menej stabilným izomérom kyseliny sulfoxylovej. Obe tieto kyseliny sú nestabilné.
Štruktúra a vlastnosti
[upraviť | upraviť zdroj]Sulfínové kyseliny sú asi tisíckrát kyslejšie než odpovedajúce karboxylové kyseliny. Kým pKa jednoduchých karboxylových kyselín vo vode je okolo 4, pKa odpovedajúcich sulfínových kyselín je 1 až 2.[2]
Sulfínová funkčná skupina má tvar pyramídy, čo znamená, že je táto skupina chirálna.[2]
Sulfínové kyseliny sú relatívne málo stabilné, často sa izolujú v podobe stabilnejších solí (sulfinátov) s kovmi.[3]
Reakcie
[upraviť | upraviť zdroj]Sulfínové kyseliny sa zvyčajne pripravujú in situ (počas reakcie) okyslením sulfinátov. Tieto soli možno bežne pripraviť redukciou sulfonylchloridov.[4] Alternatívnym spôsobom prípravy je reakcia Grignardových činidiel s oxidom siričitým.[3] Sulfináty s prechodnými kovmi vznikajú zavedením oxidu siričitého do alkylkovových zlúčenín, pričom táto reakcia môže prebiehať cez komplex kov-oxid siričitý.[chýba zdroj]
Sulfínové kyselina bežne podliehajú disproporcionácii. Podobne často dochádza k desulfinácii (štiepeniu oxidu siričitého).[2]
Význam
[upraviť | upraviť zdroj]Medzi príklady jednoduchých dobre prešstudovaných sulfínových kyselín patrí kyselina fenylsulfínová.[chýba zdroj] Komerčne dôležitou sulfínovou kyselinou je dioxid tiomočoviny, ktorý vzniká oxidáciou tiomočoviny pomocou peroxidu vodika:[5]
- (NH2)2CS + 2H2O2 → (NH)(NH2)CSO2H + 2H2O
Používa sa napríklad ako činidlo na redukciu disulfidov a hydrogenáciu aldehydov alebo ako bieliace činidlo v papierovom priemysle.[5]
Medzi ďalšie komerčne dôležité sulfánové kyseliny patrá kyselina hydroxymetylsulfánová, ktorá sa bežne používa ako sodná soľ (HOCH2SO2Na). Jej anión sa označuje ako rongalit a používa sa ako redukčné činidlo.[5]
Biologický význam
[upraviť | upraviť zdroj]Enzým cysteíndioxygenáza premieňa cysteín na cysteínsulfinát.[6] Následnou dekarboxyláciou vzniká hypotaurín,[7] ktorého oxidáciou vzniká taurín.[8]
Referencie
[upraviť | upraviť zdroj]- ↑ DEVÍNSKY, Ferdinand. Organická chémia. 2. prepracované a doplnené. vyd. Bratislava : Osveta, 2013. ISBN 9788080633882. S. 462.
- ↑ a b c d Sulphinic Acids, Esters and Derivatives. Ed. Saul Patai. [s.l.] : John Wiley & Sons, 1981. ISBN 9780470772270. DOI:10.1002/9780470772270
- ↑ a b c BULMAN PAGE, Philip C.; WILKES, Robin D.; REYNOLDS, Dominic. 2.03 - Alkyl Chalcogenides: Sulfur-based Functional Groups. Oxford : Elsevier Science, 1995-01-01. DOI: 10.1016/B0-08-044705-8/00156-4. Dostupné online. ISBN 978-0-08-044705-6. S. 113–275.
- ↑ Whitmore, F. C.; Hamilton, F. H.. Sodium p-Toluenesulfinic Acid. 1922. S. 89. DOI:10.15227/orgsyn.002.0089
- ↑ a b c Ullmann's Encyclopedia of Industrial Chemistry. [s.l.] : Wiley, 2003-03-11. (1.) DOI: 10.1002/14356007. Dostupné online. ISBN 978-3-527-30385-4. DOI:10.1002/14356007.a25_461 (po anglicky)
- ↑ DOBROTA, Dušan, a kol. Lekárska biochémia. 2. vyd. Martin : Osveta, 2016. 799 s. ISBN 978-80-8063-444-5. S. 319 – 321.
- ↑ GUION-RAIN, Marie-Christine; PORTEMER, Christiane; CHATAGNER, Fernande. Rat liver cysteine sulfinate decarboxylase: purification, new appraisal of the molecular weight and determination of catalytic properties. Biochimica et Biophysica Acta (BBA) - Enzymology, 1975-03-28, roč. 384, čís. 1, s. 265–276. Dostupné online [cit. 2024-01-28]. ISSN 0005-2744. DOI: 10.1016/0005-2744(75)90115-1.
- ↑ SUMIZU, Koichiro. Oxidation of hypotaurine in rat liver. Biochimica et Biophysica Acta, 1962-09-10, roč. 63, čís. 1, s. 210–212. Dostupné online [cit. 2024-01-28]. ISSN 0006-3002. DOI: 10.1016/0006-3002(62)90357-8.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Sulfinic acid na anglickej Wikipédii.