Ентропия
| Серия статии на тема Статистическа физика |

Формализъм
Статистически ансамбли
Квантови статистики
Потенциали
Газове от частици
Известни модели
|
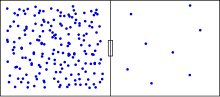

Ентропия е физична величина, която представлява мярка за безпорядъка на термодинамичните системи. Терминът „ентропия“ произхожда от гръцкия език:
Ентропията характеризира състоянието на термодинамичната система, т.е. зависи само от текущото състояние, а не от това как системата се е озовала в него.
Ентропията е правопропорционална на логаритъма на броя на възможните микросъстояния (конфигурации на градивните частици), съответстващи на дадено макросъстояние на системата. Състоянието на термодинамично равновесие се характеризира с максимална вероятност, максимален безпорядък и максимална ентропия.
Различия с други величини
[редактиране | редактиране на кода]Вътрешната енергия на системата включва общото количество механична енергия на градивните частици, докато ентропията отчита качественото различие между насочено и хаотично движение на същите частици.
Работата и количеството топлина характеризират процесите, които протичат в системата, а ентропията характеризира състоянието на системата.
Ентропията се различава и от температурата: например при изотермно нагряване температурата остава постоянна, а ентропията на системата нараства.
Газовете имат по-голяма ентропия от течностите и твърдите тела.
Основна закономерност
[редактиране | редактиране на кода]Ако в изолирана макроскопична система протича термодинамичен процес, то ентропията на системата нараства и процесът е необратим. Всички процеси в природата се подчиняват на този закон (втори принцип на термодинамиката).
История
[редактиране | редактиране на кода]Понятието „ентропия“ е въведено за първи път през 1865 г. от Рудолф Клаузиус (1822-1888), немски физик, считан за един от създателите на термодинамиката и кинетичната теория на газовете. Той предлага и една от формулировката на втория принцип на термодинамиката.
Теория
[редактиране | редактиране на кода]Класическа термодинамика
[редактиране | редактиране на кода]Изменението на ентропията
Ентропията се измерва в J/K, а специфичната ентропия – в J/(kg.K).
Названието „ентропия“ е предложено от Клаузиус.
Тази формула е приложима само за изотермни процеси. Обобщението ѝ за произволен квазистатичен процес изглежда така:
- ,
където dS е диференциалът на ентропията, а
Горната формула определя единствено изменението на ентропията, следователно задава ентропията с точност до едно неизвестно събираемо (т. нар. нулево ниво). Третият принцип на термодинамиката допълва определението на ентропията, като уточнява нейното нулево ниво: при температура, равна на абсолютната нула, ентропията на равновесна система също е нула. Това е така, тъй като абсолютната нула на температурата съответства на прекратяване на хаотичното движение на градивните частици на веществото.
Статистическа термодинамика
[редактиране | редактиране на кода]През 1877 г. Лудвиг Болцман открива, че ентропията S на една система е пропорционална на логаритъма от броя
Болцман е установил, че
- ,
където k = 1,38.10-23 J/К е т. нар. константа на Болцман. Тази формула е част от статистическата термодинамика, която описва термодинамичните системи чрез поведението на съставящите ги компоненти. Формулата на Болцман свързва микроскопичните свойства на системата (броя
От формулата на Болцман се вижда, че ентропията е функция на състоянието. Тъй като



