Acetiluri
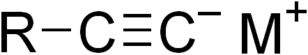
Il gruppo C≡C è legato ad un gruppo funzionale e ad un metallo, come nel propiluro di litio.
Gli acetiluri sono i composti chimici di formula generica RC≡CM o MC≡CM, in cui un metallo o un altro gruppo cationico viene sostituito ad uno o a entrambi gli atomi di idrogeno nella molecola dell'acetilene.[1] Vengono anche chiamati acetilidi, e sono importanti nella sintesi organica.
Gruppo acetiluro
[modifica | modifica wikitesto]Il gruppo acetiluro è il gruppo funzionale organico caratteristico dei composti appartenenti alla classe degli alchini e degli acetiluri, avente formula (C≡C)2-. Gli acetiluri hanno carattere ionico, che diventa evidente sottoponendo questi prodotti a idrolisi per formare acetilene e ossidi metallici.
Sintesi
[modifica | modifica wikitesto]Gli acetilati dei metalli (spesso chiamati carburi se l'idrogeno è stato sostituito da ambo i carboni) vengono sintetizzati solitamente per gorgogliamento dell'acetilene in una soluzione del metallo o di un suo sale. I composti formati sono tutti altamente esplosivi o reattivi.[2]
Acetiluri monoprotici
[modifica | modifica wikitesto]Tutti gli acetiluri a cui è sostituito solo un idrogeno al metallo ligando. Gli acetiluri di sodio o di potassio possono essere preparati da vari reagenti inorganici, per esempio la sodio ammide,[3] o dai metalli elementari, a temperatura ambiente e pressione atmosferica.[4]
Acetiluro monosodico
[modifica | modifica wikitesto]Di formula chimica .
Acetiluro monolitico
[modifica | modifica wikitesto]L'acetilene viene deprotonato dall'n-butillitio a 205 K, utilizzando tetraidrofurano come catalizzatore, andando a creare acetiluro monolitico:[5]
Anche l'esametildisilato di litio può essere usato per deprotonare l'etilene.
Con metalli del I gruppo
[modifica | modifica wikitesto]I composti acetilici dei metalli alcalino-terrosi vengono sintetizzati in ambiente anaerobico.
Sintesi dell'acetiluro di litio
[modifica | modifica wikitesto]Il carburo di litio o acetiluro di litio viene sintetizzato in vari modi:
- Si scioglie il litio metallico in ammoniaca liquida, per poi farvi gorgogliare l'acetilene
- Si fa reagire ad alta temperatura del litio fuso con della polvere di grafite
- Si fa passare dell'anidride carbonica sopra al litio fuso.
Sintesi dell'acetiluro di sodio
[modifica | modifica wikitesto]In presenza di una base molto forte come il sodio ammide l'etino (acetilene) cede un protone allo ione ammidico, formando un acetiluro salinico e ammoniaca.
Con metalli del II gruppo
[modifica | modifica wikitesto]Questo genere di reazioni richiedono di solito alte temperature.
Sintesi del carburo di calcio
[modifica | modifica wikitesto]Il carburo di calcio, di formula chimica CaC2, in cui i due carboni sono legati tra di loro da un triplo legame covalente ed al calcio ciascuno con un legame covalente polare, viene prodotto industrialmente facendo reagire a 2000 C° calce viva e carbone, tramite questa reazione:
Al contrario degli altri carburi acetilici, non si parte dall'acetilene per sintetizzare il composto ma dal composto si può produrre direttamente acetilene, semplicemente esponendo il carburo all'acqua:
Il carburo di calcio reagisce bene anche con l'umidità dell'aria.
Da metalli del blocco d
[modifica | modifica wikitesto]Un processo simile è la sintesi degli acetiluri o carburi dei metalli di transizione, dove l'acetilene viene fatto gorgogliare in una soluzione contenente il sale disciolto.
Sintesi dell'acetiluro d'argento
[modifica | modifica wikitesto]L'acetilene viene fatto gorgogliare in una soluzione di nitrato d'argento, acqua ed acido nitrico, dove forma un precipitato bianco di carburo di argento:
Sintesi dell'acetiluro di rame
[modifica | modifica wikitesto]L'acetilene viene fatto gorgogliare in una soluzione acquosa di cloruro rameoso, dove si formerà una sostanza color rosso mattone:[4]
Chimica organica
[modifica | modifica wikitesto]Gli acetiluri sono utili reagenti in chimica organica in quanto possono essere usati per allungare catene di carbonio tramite sostituzione nucleofila con alogenuri alchilici primari.
Un esempio di reazione chimica in cui un acetiluro reagisce con un metallo alcalino-terroso per formare un alcol terziario è rappresentata qui di seguito:

In cui il propionato di etile viene deprotonato dall'n-butillitio andando a formare etilpropionato di litio. Viene una mole di ciclopentanone ogni mole di etilpropionato di litio per formare un alcossido di litio (formula R–OLi, dove R è il gruppo funzionale dei complessi a cui è stato legato in precedenza). Viene quindi aggiunto dell'acido acetico per scambiare il litio con l'idrogeno dell'acido per formare l'alcol finale.[7]
- La reazione di Arens-van Drop è una reazione chimica in cui l'eptossiacetilene viene convertito in un reattivo di Grignard, poi fatto reagire con un chetone producendo alcol propargilico (C3H4O):

- La reazione di Isler è una variante della reazione di Arens-van Drop in cui l'eptossiacetilene è sostituito da etere di beta-clorovinile e litio ammide.[4]
- La reazione di Favorskii-Babayan è un processo chimico in cui dei chetoni reagiscono con gli alchini (compreso l'acetilene) in presenza di metalli alcalini:

Note
[modifica | modifica wikitesto]- ^ IUPAC Gold Book - Achetylides.
- ^ (EN) Franco Cataldo e Carlo S. Casari, Synthesis, Structure and Thermal Properties of Copper and Silver Polyynides and Acetylides, in Journal of Inorganic and Organometallic Polymers and Materials, vol. 17, n. 4, 1º dicembre 2007, pp. 641-651, DOI:10.1007/s10904-007-9150-3. URL consultato il 21 maggio 2018.
- ^ (EN) DIMETHYLETHYNYLCARBINOL, in Organic Syntheses, vol. 20, 1940, p. 40, DOI:10.15227/orgsyn.020.0040. URL consultato il 21 maggio 2018.
- ^ a b c (EN) Nikolaus von Kutepow, Chemistry of acetylenes. Von H. G. Viehe. Marcel Dekker Inc., New York 1969. 1. Aufl., XV, 1298 S., zahlr. Tab. u. Formeln, geb. $ 59.50, in Angewandte Chemie, vol. 84, n. 8, 1972-04, pp. 367-367, DOI:10.1002/ange.19720840843. URL consultato il 21 maggio 2018.
- ^ (EN) PREPARATION AND USE OF LITHIUM ACETYLIDE: 1-METHYL-2-ETHYNYL-endo-3,3-DIMETHYL-2-NORBORNANOL, in Organic Syntheses, vol. 68, 1990, p. 14, DOI:10.15227/orgsyn.068.0014. URL consultato il 21 maggio 2018.
- ^ Petrucci, Herring, Madura, Bissonnette, Chimica Generale, Padova, Piccin, 2013, p. 1177, ISBN 9788829926923.
- ^ (EN) M. Mark Midland, Alfonso Tramontano e John R. Cable, Synthesis of alkyl 4-hydroxy-2-alkynoates, in The Journal of Organic Chemistry, vol. 45, n. 1, 1980-01, pp. 28-29, DOI:10.1021/jo01289a006. URL consultato il 21 maggio 2018.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Acetiluri
Wikimedia Commons contiene immagini o altri file su Acetiluri
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) acetylide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

![Formation of lithium acetylide from acetylene + BuLi {\displaystyle {\ce {{H-\!{\equiv }\!-H}+BuLi->[{\ce {THF}}][-78^{\circ }{\ce {C}}]{Li-\!{\equiv }\!-H}+BuH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e948ddc41eda544034608783499c1dbe8e93a85)




