出典 しゅってん 百科 ひゃっか 事典 じてん
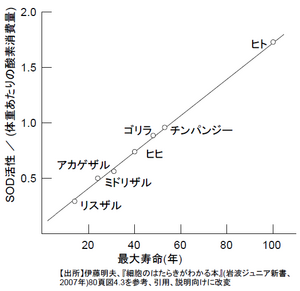
SOD活性 かっせい 寿命 じゅみょう 関係 かんけい スーパーオキシドディスムターゼ (Superoxide dismutase, SOD ) は、細胞 さいぼう 内 うち 発生 はっせい 活性 かっせい 酸素 さんそ 分解 ぶんかい 酵素 こうそ [2] 酸素 さんそ 消費 しょうひ 量 りょう 対 たい 活性 かっせい 強 つよ 寿命 じゅみょう 相関 そうかん 言 い 体重 たいじゅう 対 たい 消費 しょうひ 酸素 さんそ 量 りょう 多 おお 動物 どうぶつ 種 しゅ 寿命 じゅみょう 短 みじか 活性 かっせい 酸素 さんそ 分解 ぶんかい 寿命 じゅみょう 延 の 動物 どうぶつ 中 なか 霊長 れいちょう 類 るい ヒト はSODの活性 かっせい 高 たか 際立 きわだ 長寿 ちょうじゅ 原因 げんいん [3]
SODは、スーパーオキシドアニオン (・O2 - )を酸素 さんそ 過酸化水素 かさんかすいそ 不 ふ 均 ひとし 化 か 酸化 さんか 還元 かんげん 酵素 こうそ 活性 かっせい 中心 ちゅうしん 銅 どう イオン と亜鉛 あえん マンガン (III)イオン(MnSOD)や鉄 てつ 二 に 価 か 三 さん 価 か 金属 きんぞく 持 も 酵素 こうそ 細胞 さいぼう 質 しつ 多 おお 局在 きょくざい 酸化 さんか ストレス を減少 げんしょう 役割 やくわり 持 も 最近 さいきん ニッケル を持 も 酵素 こうそ 発見 はっけん 生成 せいせい 過酸化水素 かさんかすいそ カタラーゼ やペルオキシダーゼ などによって分解 ぶんかい
がん細胞 さいぼう では活性 かっせい 酸素 さんそ 高 こう 頻度 ひんど 産 さん 生 む 阻害 そがい 感受性 かんじゅせい 示 しめ 場合 ばあい 抗 こう 剤 ざい 標的 ひょうてき 研究 けんきゅう 行 おこな
SODの触媒 しょくばい 機能 きのう 活性 かっせい 酸素 さんそ 分解 ぶんかい 反応 はんのう 半 はん 反応 はんのう 式 しき 以下 いか 通 とお
M
(
n
+
1
)
+
−
SOD
+
O
2
−
⟶
M
n
+
−
SOD
+
O
2
{\displaystyle {\ce {M^{({\mathit {n}}{+}1)}^{+}{-}SOD{+}O2^{-}->M^{{\mathit {n}}+}{-}SOD{+}O2}}}
M
n
+
−
SOD
+
O
2
−
+
2
H
+
⟶
M
(
n
+
1
)
+
−
SOD
+
H
2
O
2
{\displaystyle {\ce {M^{{\mathit {n}}+}{-}SOD\ +O2^{-}{+}2H^{+}->M^{({\mathit {n}}{+}1)}^{+}{-}SOD{+}H2O2}}}
ここで言 い 次 つぎ Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2)
この反応 はんのう 金属 きんぞく カチオン の酸化 さんか 状態 じょうたい 間 あいだ 変動 へんどう
これらの半 はん 反応 はんのう 式 しき 以下 いか 反応 はんのう 式 しき 表 あらわ
2
O
2
−
+
2
H
+
⟶
O
2
+
H
2
O
2
{\displaystyle {\ce {2O2^- {+}2H^+ -> O2 {+}H2O2}}}
Irwin FridovichとJoe M. McCordによって発見 はっけん 酵素 こうそ 群 ぐん 以前 いぜん 未知 みち 機能 きのう 金属 きんぞく タンパク質 たんぱくしつ 考 かんが [4] 類型 るいけい タンパク質 たんぱくしつ 銅 どう 亜鉛 あえん マンガン 、鉄 てつ ニッケル が補 ほ 因子 いんし 含 ふく
ウシ亜 あ 科 か [5] SODには金属 きんぞく 補 ほ 因子 いんし 種類 しゅるい 両方 りょうほう 結合 けつごう 結合 けつごう 結合 けつごう 大別 たいべつ
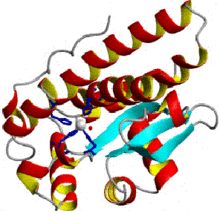
銅 どう 亜鉛 あえん 主 おも 真 ま 核 かく 生物 せいぶつ 使 つか 事実 じじつ 上 じょう 真 ま 核 かく 細胞 さいぼう 細胞 さいぼう 質 しつ 基質 きしつ 含 ふく 市販 しはん 通常 つうじょう ウシ亜 あ 科 か の細胞 さいぼう 精製 せいせい 分子 ぶんし 量 りょう 二 に 量 りょう 体 たい 亜 あ 科 か 年 ねん 初 はじ 構造 こうぞう 解明 かいめい [6] 本 ほん グリークキー でβ べーた 形成 けいせい 構造 こうぞう 活性 かっせい 部位 ぶい 表面 ひょうめん 間 あいだ 主 おも 疎水 そすい 的 てき 静電気 せいでんき 的 てき 相互 そうご 作用 さよう 背中合 せなかあ 強 つよ 結合 けつごう 銅 どう 亜鉛 あえん 個 こ ヒスチジン と1個 いっこ アスパラギン 酸 さん 側 がわ 鎖 くさり 配 はい 位 い 金属 きんぞく 原子 げんし 間 あいだ 共有 きょうゆう [7] 鉄 てつ 原核 げんかく 生物 せいぶつ 原生 げんせい 生物 せいぶつ ミトコンドリア 内 うち 使 つか 鉄 てつ E. coli と多 おお バクテリア がFe-SODを含 ふく 他 た 両方 りょうほう 含 ふく 植物 しょくぶつ 色素 しきそ 体 たい 見 み 立体 りったい 構造 こうぞう 同 おな α あるふぁ 配置 はいち 持 も 活性 かっせい 部位 ぶい アミノ酸 あみのさん 側 がわ 鎖 くさり 配置 はいち 同 おな マンガン - 鶏 にわとり 肝臓 かんぞう ミトコンドリア と多 おお バクテリア がMn-SODを含 ふく 見 み 配 はい 位 い 子 こ 個 こ 側 がわ 鎖 くさり 1個 いっこ 酸 さん 側 がわ 鎖 くさり 水 みず 配 はい 位 い 子 こ 酸化 さんか 数 すう 依存 いぞん [8] ニッケル - 原核 げんかく 生物 せいぶつ 含 ふく 右 みぎ 巻 ま 六 ろく 量 りょう 体 からだ 構造 こうぞう 末端 まったん 含 ふく ヒト (すべての哺乳 ほにゅう 動物 どうぶつ 大 だい 部分 ぶぶん 脊椎動物 せきついどうぶつ 種 しゅ 存在 そんざい SOD1 は細胞 さいぼう 質 しつ SOD2 はミトコンドリア 、SOD3 は細胞 さいぼう 外 がい 空間 くうかん 存在 そんざい 二 に 量 りょう 体 たい 他 た 種 しゅ 四 よん 量 りょう 体 からだ 銅 どう 亜鉛 あえん 含 ふく 対 たい 活性 かっせい 中心 ちゅうしん 持 も
^ PDB : 1VAR Borgstahl GE, Parge HE, Hickey MJ, Johnson MJ, Boissinot M, Hallewell RA, Lepock JR, Cabelli DE, Tainer JA (April 1996). “Human mitochondrial manganese superoxide dismutase polymorphic variant Ile58Thr reduces activity by destabilizing the tetrameric interface”. Biochemistry 35 (14): 4287–97. doi :10.1021/bi951892w . PMID 8605177 . ^ 伊藤 いとう ^ 伊藤 いとう ^ McCord JM, Fridovich I (1988). “Superoxide dismutase: the first twenty years (1968-1988)”. Free Radic. Biol. Med. 5 (5-6): 363–9. doi :10.1016/0891-5849(88)90109-8 . PMID 2855736 . ^ PDB : 2SOD Tainer JA, Getzoff ED, Beem KM, Richardson JS, Richardson DC (September 1982). “Determination and analysis of the 2 A-structure of copper, zinc superoxide dismutase”. J. Mol. Biol. 160 (2): 181–217. PMID 7175933 . ^ Richardson JS, Thomas KA, Rubin BH, Richardson DC (1975). “Crystal Structure of Bovine Cu,Zn Superoxide Dismutase at 3Å Resolution: Chain Tracing and Metal Ligands.” . Proc Nat Acad Sci USA 72 (4): 1349–53. doi :10.1073/pnas.72.4.1349 . PMC 432531 . PMID 1055410 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC432531/ . ^ Tainer JA, Getzoff ED, Richardson JS, Richardson DC (1983). “Structure and mechanism of copper, zinc superoxide dismutase.”. Nature 306 (5940): 284–7. doi :10.1038/306284a0 . PMID 6316150 . ^ PDB : 1N0J Borgstahl GE, Parge HE, Hickey MJ, Beyer WF Jr, Hallewell RA, Tainer JA (1992). “The structure of human mitochondrial manganese superoxide dismutase reveals a novel tetrameric interface of two 4-helix bundles.”. Cell 71 (1): 107–18. doi :10.1016/0092-8674(92)90270-M . PMID 1394426 .
伊藤 いとう 明夫 あきお 細胞 さいぼう 本 ほん 株式会社 かぶしきがいしゃ 岩波書店 いわなみしょてん 岩波ジュニア新書 いわなみじゅにあしんしょ 年 ねん ISBN 978-4-00-500575-8 。