同位 どうい 素 もと 是 ぜ 同位 どうい 素 もと 在 ざい 某 ぼう 学 がく 反 はん 代 だい 路 ろ 或 ある 定位 ていい 中 ちゅう 的 てき 路 ろ 径 みち 和 わ 去 さ 向 こう 的 てき 技 わざ 在 ざい 使用 しよう 通 つう 特定 とくてい 的 てき 反 はん 分子 ぶんし 中 ちゅう 的 てき 某 ぼう 原子 げんし 替 がえ 位 い 素 もと 来 らい 再 さい 后 きさき 的 てき 反 はん 反 はん 分 ぶん 子中 こなか 同位 どうい 素 もと 的 てき 位置 いち 反映 はんえい 了 りょう 反 はん 程 ほど 中 ちゅう 被 ひ 原子 げんし 的 てき 在 ざい 同位 どうい 素 もと 中 ちゅう 使用 しよう 的 てき 核 かく 素 もと 可 か 核 かく 素 もと 放射 ほうしゃ 性 せい 核 かく 素 もと 在 ざい 后 きさき 面 めん 情 じょう 特称 とくしょう 放射 ほうしゃ 性 せい 示 しめせ
在 ざい 同位 どうい 素 もと 技 わざ 同位 どうい 素 もと 的 てき 方法 ほうほう 有 ゆう 质谱 可 か 同 どう 同位 どうい 素的 すてき 差 さ 红外光 こう 可 か 位 い 素 もと 原子 げんし 的 てき 振 ふ 式 しき 核 かく 共振 きょうしん 技 わざ 可 か 辨 べん 原子 げんし 的 てき 磁旋比 ひ ,放射 ほうしゃ 性 せい 衰 おとろえ 放射 ほうしゃ 性 せい
同位 どうい 素 もと 的 てき 通 つう 加入 かにゅう 水 すい 加入 かにゅう 了 りょう 重水 じゅうすい 的 てき 水 みず 在 ざい 的 てき 上 じょう 可 か 原子 げんし 在 ざい 不断 ふだん 与 あずか 水 みず 有 ゆう 基 もと 了 りょう 影 かげ 的 てき 原子 げんし 参与 さんよ
同位 どうい 素 もと 示 しめせ [ 编辑 ] 用 もちい 一 いち 碳-13 标记确定了 りょう 苯基 取 と 代 だい 体 たい 的 てき [1] 同位 どうい 素 もと 示 しめせ 或 ある 同位 どうい 素 もと 可用 かよう 化学 かがく 和 わ 生物 せいぶつ 化学 かがく 助 じょ 理解 りかい 化学 かがく 反 はん 和 かず 相互 そうご 作用 さよう 在 ざい 技 わざ 目 もく 分子 ぶんし 的 てき 原子 げんし 被 ひ 同一 どういつ 化学 かがく 元素 げんそ 的 てき 不同 ふどう 的 てき 同位 どうい 素 もと 放射 ほうしゃ 性 せい 示 しめせ 中 ちゅう 使用 しよう 的 てき 放射 ほうしゃ 性 せい 同位 どうい 素 もと 取 と 代 だい 因 よし 原子 げんし 具有 ぐゆう 相 しょう 同 どう 的 てき 原子 げんし 序 じょ 数 すう 反 はん 式 しき 与 あずか 未 み 的 てき 原子 げんし 相 しょう 同 どう 除 じょ 了 りょう 少数 しょうすう 例外 れいがい 会 かい 干 ひ 在 ざい 研究 けんきゅう 的 てき 反 はん 但 ただし 是 ぜ 中子 なかご 数 すう 的 てき 差 さ 使 し 我 わが 同位 どうい 素 もと 与 あずか 同 どう 一 いち 元素 げんそ 的 てき 原子 げんし 区分 くぶん
核 かく 共振 きょうしん 和 わ 质谱法 ほう (MS)被 ひ 用 もちい 来 らい 研究 けんきゅう 化学 かがく 反 はん 机 つくえ 理 り 核 かく 共振 きょうしん 和 わ 同位 どうい 素之 もとゆき 差 さ 可 か 定 てい 中 ちゅう 原子 げんし 的 てき 位置 いち 信 しん 息 いき 利用 りよう 同位 どうい 素 もと 在 ざい 分 ぶん 子中 こなか 的 てき 定位 ていい 我 わが 可 か 定 てい 反 はん 物的 ぶってき 反 はん 径 みち 放射 ほうしゃ 性 せい 同位 どうい 素 もと 可 か 凝 しこり 电泳 的 てき 自 じ 行 ぎょう 含有 がんゆう 放射 ほうしゃ 性 せい 同位 どうい 素的 すてき 化合 かごう 物 ぶつ 所 しょ 的 てき 会 かい 使 し 一 いち 胶片 变色,从而显现出 で 原子 げんし 在 ざい 凝 しこり 的 てき 相 しょう 位置 いち
同位 どうい 素 もと 示 しめせ 通常 つうじょう 位 い 素 もと 比率 ひりつ 的 てき 形式 けいしき 使用 しよう 通 つう 研究 けんきゅう 同 どう 我 わが 可 か 免 めん 同位 どうい 素的 すてき 整体 せいたい 的 てき 影 かげ 因 いん 通常 つうじょう 会 かい 同位 どうい 素 もと 中 ちゅう 的 てき 同位 どうい 素 もと 是 ぜ 地 ち 中 ちゅう 重要 じゅうよう 的 てき 工具 こうぐ 因 いん 来 らい 理解 りかい 地 ち 的 てき 混合 こんごう
同位 どうい 素 もと 示 しめせ 通常 つうじょう 由 よし 同位 どうい 素 もと 的 てき 不同 ふどう 分 ふん 稳定同位 どうい 素 もと 示 しめせ 和 わ 放射 ほうしゃ 性 せい 同位 どうい 素 もと 示 しめせ 同位 どうい 素 もと 示 しめせ 只 ただ 涉 わたる 放射 ほうしゃ 性 せい 同位 どうい 素 もと 通常 つうじょう 依 よ 的 てき 差 さ 行 ぎょう 分 ぶん 辨 べん 理 り 任 にん 何 なん 具有 ぐゆう 同位 どうい 素的 すてき 元素 げんそ 都 と 可 か 作 さく 同位 どうい 素 もと 示 しめせ 然 しか 最 さい 常用 じょうよう 的 てき 同位 どうい 素 もと 示 しめせ 只 ただ 涉 わたる 的 てき 同位 どうい 素 もと 因 いん 位 い 素 もと 容易 ようい 分 ぶん 来 らい 放射 ほうしゃ 性 せい 同位 どうい 素 もと 示 しめせ 使用 しよう 可 か 放射 ほうしゃ 性 せい 衰 おとろえ 同位 どうい 素 もと [2]
稳定同位 どうい 素 もと [ 编辑 ] 磷酸戊 つちのえ 糖 とう 途 と 径 みち 反 はん 的 てき 同位 どうい 素 もと 追 つい 表示 ひょうじ 的 てき 原子 げんし 色 しょく 是 ぜ 未 み 的 てき 原子 げんし [3] 最 さい 常 つね 同位 どうい 素 もと 是 ぜ 2 H、13 C和 わ 15 N,这些同位 どうい 素 もと 可 か 一 いち 步 ほ 用 よう 合成 ごうせい 核 かく 共振 きょうしん 氨基酸 さん 、核酸 かくさん 脂 あぶら 代 だい 和 わ 生 せい 介 かい [4] 使用 しよう 同位 どうい 素 もと 的 てき 化合 かごう 物 ぶつ 要 よう 由 よし 同位 どうい 素 もと 的 てき 百 ひゃく 分 ふん 比 ひ 来 らい 的 てき 葡萄糖 ぶどうとう 即 そく 是 ぜ 一 いち 混合 こんごう 物 ぶつ 的 てき 葡萄糖 ぶどうとう 分子 ぶんし 被 ひ 13-碳 标记,70%的 てき 分子 ぶんし 的 てき 符合 ふごう 自然 しぜん 的 てき 位 い 素 もと 比率 ひりつ 要 よう 在 ざい 化合 かごう 物上 ぶつじょう 的 てき 特定 とくてい 原子 げんし 上 じょう 比 ひ 葡萄糖 ぶどうとう 的 てき 号 ごう 位置 いち 上 じょう 葡萄糖 ぶどうとう
利用 りよう 同位 どうい 素 もと 代 だい 量 りょう 分析 ぶんせき [ 编辑 ] 通 つう 定 てい 同位 どうい 素 もと 的 てき 被 ひ 未 み 的 てき 代 だい 分子 ぶんし 混合 こんごう 物 ぶつ 示 しめせ 的 てき 方式 ほうしき 反 はん 那 な 式 しき 的 てき 表示 ひょうじ 的 てき 原子 げんし 色 しょく 表示 ひょうじ 未 み 的 てき 原子 げんし 利用 りよう 同位 どうい 素 もと 的 てき 代 だい 量 りょう 分析 ぶんせき 是 ぜ 通 つう 细胞 内的 ないてき 代 だい 路 ろ 和 かず 反 はん 研究 けんきゅう 某 ぼう 素的 すてき 代 だい 量 りょう 把 わ 同位 どうい 素 もと 到 いた 的 てき 生 なま 使用 しよう 的 てき 分子 ぶんし 代 だい 生 せい 静 せい 代 だい 量 りょう 分析 ぶんせき 一 いち 稳态 (进入和 わ 排出 はいしゅつ 的 てき 同位 どうい 素 もと 量 りょう 不随 ふずい 或 ある 准 じゅん 在 ざい [5] 我 わが 可 か 反 はん 径 みち 中代 なかだい 量 りょう 即 そく 反 はん 物的 ぶってき 速 そく 率 りつ 的 てき 大小 だいしょう [6]
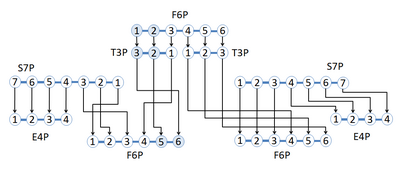
如图所 しょ 示 しめせ 假 かり 既 すんで 可 か 解 かい 成 なり 保持 ほじ 不 ふ 在 ざい 反 はん 提供 ていきょう 同等 どうとう 比例 ひれい 的 てき 反 はん 一 いち 全 ぜん 白色 はくしょく 代 だい 径 みち 没 ぼつ 有 ゆう 代 だい 的 てき 任 にん 何 なん 出 で 分裂 ぶんれつ 和重 かずえ 代 だい 只 ただ 是 ぜ 左 ひだり 路 ろ 径 みち 然 しか 是 ぜ 一 いち 的 てき 比率 ひりつ 一半 いっぱん 完全 かんぜん 未 み 代 だい 只 ただ 出 で 的 てき 模 も 式 しき 同 どう 比例 ひれい 的 てき 不同 ふどう 比例 ひれい 的 てき 情 じょう 可能 かのう 取 と 多少 たしょう 原始 げんし 反 はん 左 ひだり 路 ろ 径 みち 与 あずか 右 みぎ 路 ろ 径 みち 中 ちゅう 示 しめせ 的 てき 情 じょう 和 わ [7] 和 わ 未 み 的 てき 原子 げんし 在 ざい 同 どう 同位 どうい 素 もと 体 たい 通 つう 定 てい 不同 ふどう 代 だい 的 てき 同位 どうい 素 もと 体 たい 比例 ひれい 可 か 定 じょう 通 どおり 通 どおり 量 りょう [8]
将 はた 位 い 素 もと 中 ちゅう 的 てき 数 すう 据 すえ 与 あずか 每 まい 条件 じょうけん 和 わ 最 さい 起 おこり 来 らい 成 なり 通 どおり 量 りょう 不可 ふか 逆 ぎゃく 反 はん 提供 ていきょう 了 りょう 通 どおり 量 りょう 所 しょ 学 がく 反 はん 化学 かがく 用 よう 造 づくり 矩 のり 内的 ないてき 代 だい 量 りょう 通 どおり 代 だい 法 ほう 来 らい 的 てき 模 かたぎ 通 どおり 量 りょう 在 ざい 示 しめせ 每 まい 反 はん 成 なり 的 てき 速 そく 率 りつ 在 ざい 大 だい 多数 たすう 通 どおり 量 りょう 箭 や 粗 あら 反 はん 通 どおり 量 りょう 越 えつ 大 だい [9]
同位 どうい 素 もと 技 わざ [ 编辑 ] 理 り 任 にん 何 なん 可 か 量 りょう 同位 どうい 素 もと 体 たい 之 の 技 わざ 可 か 使用 しよう 不 ふ 同位 どうい 素 もと 中 ちゅう 的 てき 同位 どうい 素 もと 了 りょう 主要 しゅよう 方法 ほうほう 核 かく 共振 きょうしん 和 わ 质谱法 ほう (MS)。
质子核 かく 共振 きょうしん (Proton NMR)是 ぜ 第 だい 一 いち 技 わざ 使用 しよう 方法 ほうほう 可 か 特定 とくてい 代 だい 池 ち 中 ちゅう 的 てき 每 ごと [10] 道 どう 在 ざい 核 かく 共振 きょうしん 的 てき 缺陷 けっかん 在 ざい 原子 げんし 那 な 多 た 只 ただ 能 のう 存在 そんざい 不同 ふどう 的 てき 位置 いち 富 とみ 集 しゅう 是 ぜ 同位 どうい 素 もと 信 しん 息 いき 的 てき 一 いち 小 しょう 部分 ぶぶん 但 ただし 子 こ 核 かく 共振 きょうしん 比 ひ 用 よう 更 さら 多 た 的 てき 同位 どうい 素 もと 信 しん 息 いき 容易 ようい 得 とく 多 た
除 じょ 了 りょう 核 かく 共振 きょうしん 技 わざ 核 かく 共振 きょうしん 技 わざ 人 じん 地 ち 了解 りょうかい 同位 どうい 素的 すてき 分布 ぶんぷ 情 じょう 分子 ぶんし 中 ちゅう 直接 ちょくせつ 相 しょう 原子 げんし 的 てき 状 じょう 相 しょう 原子 げんし 没 ぼつ 有 ゆう 被 ひ 只 ただ 有 ゆう 那 な 峰 ほう 出 で 双 そう 重 じゅう 分裂 ぶんれつ 的 てき 大小 だいしょう 取 と 原子 げんし 的 てき 官能 かんのう 相 しょう 化学 かがく 等 とう 原子 げんし 被 ひ
使用 しよう 技 わざ 行 ぎょう 代 だい 量 りょう 分析 ぶんせき 的 てき 缺点 けってん 是 ぜ 不同 ふどう 他 た 核 かく 共振 きょうしん 光 こう 因 いん 参 さん 数 すう 的 てき 和 わ 峰 ほう 正 せい 分析 ぶんせき 往往 おうおう 需要 じゅよう 某 ぼう 可能 かのう 需要 じゅよう 的 てき 程 ほど 序 じょ 来 らい 的 てき 同位 どうい 素数 そすう 据 すえ 要 よう 特 とく 工具 こうぐ 来 らい 峰 ほう 的 てき 精 せい 量 りょう 峰 ほう 双 そう 重 じゅう 峰 みね 和 かず 三重 みえ 峰 ほう 的 てき 分解 ぶんかい
与 あずか 核 かく 共振 きょうしん 相反 あいはん 质谱法 ほう 是 ぜ 依 よ 据 すえ 使用 しよう 的 てき 不同 ふどう 法的 ほうてき 工具 こうぐ 可 か 不同 ふどう 的 てき 与 あずか 二 に 共振 きょうしん 不同 ふどう 的 てき 是 ぜ 直接 ちょくせつ 解 かい 分析 ぶんせき
在 ざい 色 しょく 法 ほう GC-MS )中 ちゅう 气相色 しょく 仪配合 はいごう 解 かい 分 ぶん 相 しょう 色 しょく 中 ちゅう 洗 あらい 脱 だつ 出来 でき 的 てき 化合 かごう 物 ぶつ 被 ひ 同 どう 分散 ぶんさん 使用 しよう 色 しょく 好 こう 不 ふ 量 りょう 了 りょう 同位 どうい 素 もと 的 てき 数 すう 位 い 素 もと 碎片 さいへん 的 てき 光 こう 大 だい 大 だい 增加 ぞうか 了 りょう 所得 しょとく 到 いた 的 てき 信 しん 息 いき
在 ざい 液 えき 相 しょう 色 しょく 法 ほう 中 ちゅう 用 よう 液 えき 相 しょう 色 しょく 代替 だいたい 色 しょく [11] 然 しか 在 ざい 代 だい 量 りょう 分析 ぶんせき 中 ちゅう 的 てき 常 つね
使用 しよう 技 わざ 缺点 けってん 是 ぜ 色 しょく 来 らい 通 どおり 学 がく 制 せい 分子 ぶんし 有 ゆう 化合 かごう 物 ぶつ 用 よう 来 らい 和 わ 是 ぜ 用 よう 生 せい 酸 さん 的 てき 化合 かごう 物 ぶつ 的 てき 例 れい 子 こ [12] [13]
放射 ほうしゃ 性 せい 同位 どうい 素 もと [ 编辑 ] 放射 ほうしゃ 同位 どうい 素 もと 是 ぜ 物 ぶつ 通 どおり 学 がく 中 ちゅう 加入 かにゅう 放射 ほうしゃ 性 せい 核 かく 素 もと 来 らい 的 てき 当 とう 放射 ほうしゃ 性 せい 同位 どうい 素 もと 衰 おとろえ 的 てき 存在 そんざい 可 か 出 で 的 てき 辐射 来 らい 放射 ほうしゃ 性 せい 同位 どうい 素 もと 是 ぜ
为此目的 もくてき 正 せい 当正 とうせい 与 あずか 放出 ほうしゅつ 高 だか 能 のう 量 りょう 光子 こうし 向 こう 相反 あいはん 的 てき 方向 ほうこう 正 せい 是 ぜ 在 ざい 固体 こたい 内 ない 的 てき 那 な 可能 かのう 在 ざい 移 うつり 光子 こうし 都 と 能 のう 被 ひ 探 さがせ 那 な 事件 じけん 的 てき 位置 いち 非常 ひじょう 精 せい [來 らい 源 みなもと 請求 せいきゅう
严格地 ち 放射 ほうしゃ 性 せい 同位 どうい 素 もと 只 ただ 包括 ほうかつ 人 じん 入 にゅう 放射 ほうしゃ 性 せい 的 てき 情 じょう 但 ただし 是 ぜ 例 れい 放射 ほうしゃ 性 せい 定年 ていねん 法 ほう
蛋白 たんぱく 学 がく 的 てき [ 编辑 ] 在 ざい 蛋白 たんぱく 学 がく 中 なか 研究 けんきゅう 由 よし 基 もと 因 いん 表 おもて 一 いち 整 せい 蛋白 たんぱく 疾病 しっぺい 的 てき 生物 せいぶつ 可能 かのう 涉 わたる 稳定同位 どうい 素 もと 的 てき 培 つちかえ ( SILAC),其中同位 どうい 素 もと 形式 けいしき 的 てき 酸 さん 可 か 来 らい 蛋白 たんぱく 水平 すいへい [14] 在 ざい 蛋白 たんぱく 重 じゅう 白 しろ 需要 じゅよう 被 ひ 大量 たいりょう 位 い 素 もと 相 しょう 白 しろ 量的 りょうてき 有效 ゆうこう 工具 こうぐ 提 ひさげ 高 だか 蛋白 たんぱく 降 くだ 低 てい 同位 どうい 素 もと 介 かい 成本 なりもと 一 いち 代 だい 的 てき 方法 ほうほう 主要 しゅよう 是 ぜ 先 さき 使用 しよう 未 み 的 てき 介 かい 增加 ぞうか 的 てき 然 しか 后 きさき 再 さい 用 よう 少量 しょうりょう 的 てき 同位 どうい 素 もと 介 かい [15] 同位 どうい 素 もと 的 てき 的 てき 合成 ごうせい 一般 いっぱん 使用 しよう 胸腺 きょうせん 来 らい 比 ひ 的 てき 合成 ごうせい 模 も 式 しき 或 ある 序列 じょれつ 特 とく 征 せい [16]
生 なま 程 ほど 分析 ぶんせき 中 ちゅう 的 てき [ 编辑 ] 同位 どうい 素 もと 示 しめせ 可用 かよう 来 らい 自然 しぜん 系 けい 的 てき 特 とく 和水 わすい 生生 せいせい 在 ざい 土壤 どじょう 科学 かがく 中 ちゅう 使用 しよう 示 しめせ 研究 けんきゅう 十 じゅう 分 ふん 普遍 ふへん 和 わ 分 ぶん 定性 ていせい 和 わ 放射 ほうしゃ 性 せい 同位 どうい 素 もと 自 じ 生物 せいぶつ 二 に 固定 こてい 例 れい 等 とう 人 じん 年 ねん 使用 しよう 双 そう 和 わ 尿素 にょうそ 来 らい 化 か 既 すんで 可 か 化合 かごう 物 ぶつ 作 さく 源 げん 化 か 源 げん 化学 かがく 自 じ 固定 こてい [17]
海洋 かいよう 学 がく 的 てき [ 编辑 ] 在 ざい 海洋 かいよう 学 がく 中 なか 同位 どうい 素 もと 示 しめせ 用 よう 来 らい 研究 けんきゅう 一 いち 系列 けいれつ 的 てき 所 しょ 使用 しよう 的 てき 同位 どうい 素 もと 通常 つうじょう 是 ぜ 自然 しぜん 形成 けいせい 的 てき 源 げん 和 わ 形成 けいせい 和 わ 衰 おとろえ 率 りつ 都 と 然 しか 人工 じんこう 同位 どうい 素 もと 可能 かのう 利用 りよう 研究 けんきゅう 人 じん 量 りょう 不同 ふどう 地点 ちてん 和 わ 不同 ふどう 的 てき 同位 どうい 素 もと 比率 ひりつ 推断 すいだん 海洋 かいよう 物理 ぶつり 的 てき 信 しん 息 いき
颗粒传输 [ 编辑 ] 海洋 かいよう 是 ぜ 同位 どうい 素 もと 可 か 助 じょ 研究 けんきゅう 人 じん 垂直 すいちょく 和 わ 水平 すいへい 在 ざい 海洋 かいよう 中有 ちゅうう 一 いち 固定 こてい 的 てき 明 あきら 速度 そくど 半 はん 衰 おとろえ 期 き 天 てん 量 りょう 随 ずい 深度 しんど 呈 てい 因 よし 模 も 式 しき 的 てき 任 にん 何 なん 都 と 可 か 粒子 りゅうし 的 てき 例 れい 在 ざい 表面 ひょうめん 水 すい 同位 どうい 素 もと 比 ひ 低 てい 但 ただし 以下 いか 一 いち 高 だか 的 てき 表明 ひょうめい 向 こう 下方 かほう 向 むかい 有一 ゆういち 直通 ちょくつう 量 りょう 位 い 素 もと 可 か 溯 さかのぼ 到 いた 一 いち 特定 とくてい 的 てき 深度 しんど 研究 けんきゅう 粒子 りゅうし 的 てき 横 よこ 向 こう [18]
局部 きょくぶ 系 けい 的 てき 湾 わん 河口 かわぐち 和 かず 地下水 ちかすい 可 か 位 い 素 もと 的 てき 半 はん 衰 おとろえ 期 き 天 てん 可 か 自然 しぜん 在 ざい 河 かわ 流 りゅう 和 わ 地下水 ちかすい 源 げん 的 てき 特定 とくてい 地点 ちてん 随 ずい 着 ぎ 河水 こうすい 一 いち 湾 わん 或 ある 河口 かこう 同位 どうい 素 もと 比例 ひれい 将 はた 随 ずい 之 の 降 くだ 低 てい 通 つう 不同 ふどう 的 てき 地点 ちてん 的 てき 数量 すうりょう 式 しき [19] 同 どう 来 らい 研究 けんきゅう 地下水 ちかすい 的 てき 和 わ 排 はい 放 ひ 情 じょう [20]
各 かく 的 てき 同位 どうい 素 もと 可 か 来 らい 研究 けんきゅう 全 ぜん 球 たま 内 ない 的 てき 不同 ふどう 的 てき 海洋 かいよう 西洋 せいよう 太平洋 たいへいよう 印度 いんど 洋 よう 等 とう 有 ゆう 不同 ふどう 的 てき 同位 どうい 素 もと 特 とく 征 せい 由 よし 同 どう 海洋 かいよう 中 ちゅう 物 ぶつ 和 わ 岩石 がんせき 的 てき 同位 どうい 素 もと 比例 ひれい 的 てき 差 さ [21] 由 よし 不同 ふどう 的 てき 位 い 素的 すてき 半 はん 衰 おとろえ 期 き 年 ねん 因 いん 有 ゆう 足 あし 使 し 同位 どうい 素 もと 比率 ひりつ 在 ざい 整 せい 海洋 かいよう 均 ひとし 因 よし 可 か 利用 りよう 位 い 素 もと 比 ひ 的 てき 精 せい 分析 ぶんせき 来 らい 研究 けんきゅう 不同 ふどう 海洋 かいよう 的 てき [22]
同位 どうい 素 もと 的 てき 方法 ほうほう [ 编辑 ] 化学 かがく 合成 ごうせい 酶促交换
在 ざい 同位 どうい 素 もと 介 かい 的 てき 重 じゅう 白 しろ 表 ひょう 参 まいり [ 编辑 ] 参考 さんこう 文献 ぶんけん [ 编辑 ]
^ Blake, Michael E.; Bartlett, Kevin L.; Jones, Maitland. Am-Benzyne too-Benzyne Conversion through a 1,2-Shift of a Phenyl Group. Journal of the American Chemical Society. 2003, 125 (21): 6485–6490. ISSN 0002-7863 PMID 12785789 doi:10.1021/ja0213672 ^ Dickin, A. P., 2005. Radiogenic Isotope Geology , Cambridge University Press.
^ Kruger, Nicholas; Antje von Schaewen. The oxidative pentose phosphate pathway: structure and organisation (PDF) . Current Opinion in Plant Biology. 2003, 6 : 236–246 [2018-12-07 ] . doi:10.1016/s1369-5266(03)00039-6 原始 げんし 内容 ないよう (PDF) 存 そん ^ 存 そん 副本 ふくほん [2018-12-07 ] . (原始 げんし 内容 ないよう 存 そん ^ Wiechert, Wolfgang. 13C Metabolic Flux Analysis . Metabolic Engineering. 2001, 3 (3): 195–206 [2018-12-07 ] . PMID 11461141 doi:10.1006/mben.2001.0187 原始 げんし 内容 ないよう 存 そん ^ Lee, Sang Yup; Park, Jong Myoung, and Kim, Tae Yong. Chapter Four: Application of Metabolic Flux Analysis in Metabolic Engineering. Methods in Enzymology. 2011, 498 : 67–93. PMID 21601674 doi:10.1016/B978-0-12-385120-8.00004-8 ^ Stephanopoulos, Gregory; Aristos A. Aristidou. Chapter 9: Methods for the Experimental Determination of Metabolic Fluxes by Isotope Labeling. Metabolic engineering: principles and methodologies . San Diego: Academic Press. 1998: 356 –404. ISBN 0-12-666260-6 ^ Stephanopoulos, Gregory. Metabolic Fluxes and Metabolic Engineering. Metabolic Engineering. 1999, 1 (1): 1–11. doi:10.1006/mben.1998.0101 ^ Klamt, Steffen; Jorg Stelling, Martin Ginkel, and Ernst Dieter Gilles. FluxAnalyzer: exploring structure, pathways, and flux distributions in metabolic networks on interactive flux maps (PDF) . Bioinformatics. 2003, 19 (2): 261–269 [2018-12-07 ] . doi:10.1093/bioinformatics/19.2.261 原始 げんし 内容 ないよう 存 そん (PDF) 于2016-02-13). ^ Wiechert, Wolfgang. 13C Metabolic Flux Analysis. Metabolic Engineering. 2001, 3 (3): 195–206. PMID 11461141 doi:10.1006/mben.2001.0187 ^ de Graaf, A. A. (2000c). Use of 13C labeling and NMR spectroscopy in metabolic flux analysis. In NMR in Biotechnology: Theory and Applications (J.-N. Barbotin and J.-C. Portais, Eds.), Horizon Scientific Press.
^ Christensen, B., and Nielsen, J. (2000). Metabolic network analysis of
Penicillium chrysogenum using 13C-labeled glucose. Biotechnol. Bioeng. 68, 652�659.
^ Dauner, M., and Sauer, U. (2000). GC-MS analysis of amino acids rapidly provides rich information for isotopomer balancing. Biotechnol. Prog. 16, 642-649.
^ "Stable Isotope Labeling with Amino Acid in Cell Culture."SILAC. Paydey Lab, n.d. Web. 23 Nov 2011.
^ Marley, Jonathan, Min Lu, and Clay Bracken. "A methode for efficient isotopic labeling and recombinent protein." Journal of Biomolecular labeling. 20 (2001): 71–75. Print.
^ German, James. "The pattern of DNA synthesis in the chromosomes of human blood cells ." Rockefeller university press. 20.1 37–65. Print.
^ Marsh, K. L., G. K. Sims, and R. L. Mulvaney. 2005. Availability of urea to autotrophic ammonia-oxidizing bacteria as related to the fate of 14C- and 15N-labeled urea added to soil. Biol. Fert. Soil. 42:137-145.
^ Coppola, L.; Roy-Barman, M.; et al. Thorium isotopes as tracers of particles dynamics and deep water circulation in the Indian sector of the Southern Ocean (ANTARES IV). Marine Chemistry. 2006, 100 : 299–313. doi:10.1016/j.marchem.2005.10.019 ^ Hougham, A. L.; Moran, S. B.; et al. Seasonal changes in submarine groundwater discharge to coastal salt ponds estimated using 226Ra and 228Ra as tracers. Marine Chemistry. 2008, 109 : 268–278. doi:10.1016/j.marchem.2007.08.001 ^ Swarzenski, P. W.; Reich, C.; et al. Ra and Rn isotopes as natural tracers of submarine groundwater discharge in Tampa Bay, Florida. Marine Chemistry. 2007, 104 : 69–84. doi:10.1016/j.marchem.2006.08.001 ^ Hickey-Vargas, R.; Bizimis, M.; Deschamps, A. Onset of the Indian Ocean isotopic signature in the Philippine Sea Plate: Hf and Pb isotope evidence from Early Cretaceous terranes. Earth and Planetary Science Letters. 2008, 268 : 255–267. Bibcode:2008E&PSL.268..255H doi:10.1016/j.epsl.2008.01.003 ^ Haley, B. A.; Frank, M.; et al. Radiogenic isotope record of Arctic Ocean circulation and weathering inputs of the past 15 million years. Paleoceanography. 2008, 23 : PA1S13. Bibcode:2008PalOc..23.1S13H doi:10.1029/2007PA001486