Το διβοράνιο(6)[2] (αγγλικά diborane(6)) είναι ανόργανη χημική ένωση, που περιέχει υδρογόνο και βόριο, με χημικό τύπο B2H6.
Το χημικά καθαρό διβοράνιο(6), στις συνηθισμένες συνθήκες, δηλαδή θερμοκρασία 25 °C και πίεση 1 atm, είναι άχρωμο αέριο με απωθητική αλλά γλυκιά οσμή. Το διβοράνιο(6) αναμιγνύεται καλά με τον ατμοσφαιρικό αέρα, σχηματίζοντας εύκολα εκρηκτικά μίγματα. Το διβοράνιο(6) αναφλέγεται έντονα με την παρουσία υγρασίας, ακόμη και σε θερμοκρασία δωματίου (20 °C). Το διβοράνιο είναι κομβικής σημασίας ένωση του βορίου με μια ποικιλία εφαρμογών.
Το διβοράνιο(6) συνθέθηκε για πρώτη φορά το 19ο αιώνα, με υδρόλυση βοριούχων μετάλλων, αλλά δεν είχε (τότε) ποτέ αναλυθεί (και ταυτοποιηθεί). Από το 1912 ως το 1936, ο Άλφρεντ Στοκ (Alfred Stock), που ήταν ο μεγάλος πρωτοπόρος στη χημεία των υδριδίων του βορίου, ανέλαβε την έρευνα που οδήγησε στις μεθόδους σύνθεσης και χειρισμού των πολύ δραστικών, πτητικών, και συχνά τοξικών υδριδίων του βορίου. Πρότεινε μια πρώτη δομή, που έμοιαζε με αυτήν του αιθανίου, για το διβοράνιο(6)[3]. Κάποιες μετρήσεις με περίθλαση ηλεκτρονίων από τον Σ. Χ. Μπάουες (S. H. Bauer) αρχικά φάνηκαν να υποστηρίζουν αυτήν την προτεινόμενη δομή[4][5].
Εξαιτίας μιας προσωπικής επικοινωνίας με τον Λάινους Πόλινγκ (L. Pauling), που υποστήριξε την όμοια με του αιθανίου δομή για το βοράνιο(6), ο Χέρμαν Ίρβινγκ Σχλέσινκερ (Hermann Irving Schlesinger) δεν συζήτησε ειδικότερα τη δεσμολογία τριών κέντρων-δύο ηλεκτρονίων στη μεταγενέστερη κλασσική επανεξέτασή του, στις αρχές της δεκαετίας του 1940[6]. Η επανεξέταση, ωστόσο, συζήτησε τη δομή C2v σε κάποιο βάθος: «Έχει αναγνωριστεί ότι αυτή η τυπολογία αντιπροσωπεύει εύκολα για πολλές από τις χημικές ιδιότητες του διβορανίου(6)...» ("It is to be recognized that this formulation easily accounts for many of the chemical properties of diborane...").
Το 1943, ο (τότε) προπτυχιακός φοιτητής στο Κολλέγιο Μπάλλιολ της Οξφόρδης (Balliol College, Oxford), ο Χ. Κρίστοφερ Λόγκαετ-Χίγκινς (H. Christopher Longuet-Higgins), δημοσίευσε τη δομή που είναι πλέον (προς το παρόν τουλάχιστον) δεκτή, μαζι με τον Ρόνυ Μπελλ (Rοny P. Bell)[7]. Αυτή η δομή είχε ήδη περιγραφεί από το 1921[8][9][10]. Στα χρόνια που ακολούθησαν παρατηρήθηκε μια έντονη συζήτηση για το αν η πρόταση Λόγκαετ-Χίγκινς/Μπελλ αντιστοιχεί με τη σωστή δομή. Η διαφωνία αυτή τερματίστηκε μετά από τις μετρήσεις με περίθλαση ηλεκτρονίων που έγιναν το 1951 από τους Κ. Χέντμπεργκ (K. Hedberg) και Β. Σχομέικερ (V. Schomaker), που επιβεβαίωσε τη δομή αυτή«Hedberg, K.; Schomaker, V. (1951). "A Reinvestigation of the Structures of Diborane and Ethane by Electron Diffraction". Journal of the American Chemical Society 73 (4): 1482–1487. doi:10.1021/ja01148a022.».
Ο Γουΐλιαμ Νουν Λίπσκομπ ο Νεώτερος (William Nunn Lipscomb, Jr.) επιβεβαίωσε τη μοριακή δομή των βορανίων χρησιμοποιώντας κρυσταλλογραφία ακτίνων X κατά τη δεκαετία του 1950 και ανέπτυξε θεωρίες για την επεξήγηση αυτής της δεσμολογίας. Αργότερα, εφάρμοσε τις ίδιες μεθόδους για συγγενικά προβλήματα, που περιλάμβαναν τη δομή των καρβοβορανίων, πάνω στα οποία κατευθύθηκε η έρευνα που οδήγησε στο Βραβείο Νόμπελ τον Ρόαλντ Χόφμαν (Roald Hoffmann). Ο Γουΐλιαμ Νουν Λίπσκομπ ο Νεώτερος έλαβε επίσης το Βραβείο Νόμπελ Χημείας το 1976, για τις προσπάθειές του.
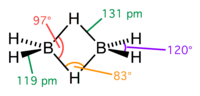
Το διβοράνιο υιοθετεί μια δομή συμμετρίας D2h, που περιέχει τέσσερα (4) «τερματικά» και δυο (2) άτομα υδρογόνου «γέφυρας», τα οποία περιβάλλουν τα δυο (2) άτομα βορίου που δεν συνδέονται μεταξύ τους με δεσμούς. Το μοντέλο αυτό καθορίστηκε από τη θεωρία των μοριακών τροχιακών. Δίνει κλασσικούς και τυπικούς ομοιοπολικούς δεσμούς μεταξύ των ατόμων βορίου και των τερματικών ατόμων υδρογόνου, δηλαδή δεσμούς τύπου σ (1s - 2sp²) μήκους 119 pm και πόλωση 5‰ (B+-H-). Μεταξύ, όμως, των ατόμων βορίου και των ατόμων υδρογόνου γέφυρας. σχηματίζονται ομοιοπολικοί δεσμοί «μπανάνας», δηλαδή 3 πυρήνων (B Η B) και 2 ηλεκτρονίων. Η απόσταση μεταξύ των πυρήνων είναι 131 pm. Οι γωνίες για τα άτομα της γέφυρας είναι 83° η BHB και 97° η (HBH). Η διαφορά μήκους στα δυο είδη δεσμών αντικατοπτρίζει και τη διαφορά ισχύος, άρα και της σταθερότητάς τους. Οι δεσμοί των τερματικών υδρογόνων είναι ισχυρότεροι και πιο σταθεροί. Η δομή είναι ισοηλεκτρονική με του ιόντος [C2H6]2+ που προκύπτει από τη διπρωτονίωση του αιθενίου[11]. Το διβοράνιο είναι μία από τις πολλές ενώσεις με τέτοια ασυνήθιστη δεσμολογία[12].
Από τα άλλα χημικά στοιχεία της 3ης ομάδας του Περιοδικού Συστήματος, το γάλλιο σχηματίζει μια ανάλογη σταθερή ένωση, το διγαλλάνιο (Ga2H6). Το αργίλιο σχηματίζει μια ασταθή, αλλά απομονώσιμη, ανάλογη ένωση που παίρνει το όνομα διαργιλάνιο (Al2H6)[13]. Μέχρι τώρα δεν έχουν ανακαλυφθεί υδρίδια του ίνδιου και του θάλλιου[14].
Οι εκτεταμένες μελέτες πάνω στο διβοράνιο(6) οδήγησαν στην ανάπτυξη πολλών μεθόδων συνθέσεώς του. Οι περισσότερες περιλαμβάνουν αντιδράσεις δοτών υδριδίου από τη μια και αλογονιδίων του βορίου ή αλκοξειδίων του από την άλλη.
1. Η βιομηχανική μέθοδος σύνθεσης του διβορανίου(6) περιλαμβάνει την αναγωγή τριφθοριούχου βορίου (BF3) από υδρίδιο του νατρίου (NaH) ή από υδρίδιο του λιθίου (LiH):
1. Η βιομηχανική μέθοδος παραγωγής του περιλαμβάνει την αναγωγή τριφθοριούχου βορίου (BF3) από υδρίδιο του νατρίου (NaH):

ή

2. Δυο εργαστηριακοί μέθοδοι αρχίζουν α) με τριχλωριούχο βόριο (BCl3) και λιθιοαργιλιοϋδρίδιο (LiAlH4) και β) με τριφθοριούχο βόριο (BF3) και νατριοβοριοϋδρίδιο (NaBH4). Και οι δυο αυτές μέθοδοι δίνουν μέχρι 30% απόδοση:

ή

3. Παλαιότερες μέθοδοι περιλάμβαναν την απευθείας επίδραση αλάτων του βοριουδριδίου (BH4-) με ένα μη οξειδωτικό οξύ, όπως το φωσφορικό οξύ (H3PO4) ή το αραιό θειικό οξύ (H2SO4):

4. Παρομοίως, η οξείδωση των αλάτων του βοριοϋδριδίου (BH4-) έχει επίσης επιδειχθεί και παραμένει βολική για μικρής κλίμακας παραγωγή διβορανίου(6). Ένα τέτοιο παράδειγμα είναι η χρήση στοιχειακού ιωδίου ως οξειδωτικό. Χρησιμοποιείται τετραϋδροφουράνιο ως διαλύτης:

5. Μια άλλη, μικρής κλίμακας μέθοδος σύνθεσης διβορανίου(6) χρησιμοποιεί (ομοίως με τη #3) καλιοβοριοϋδρίδιο (KBH4) και φωσφορικό οξύ, ως αρχικές ύλες[15]:

6. Υπάρχει επίσης και η ακόλουθη μέθοδος Χέστελλουνγκ (Herstellung method):
![{\displaystyle \mathrm {B_{2}O_{3}+2Al+3H_{2}+AlCl_{3}{\xrightarrow[{750\;bar}]{150^{o}C}}B_{2}H_{6}+3AlOCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c527ebf15c840f2669feba97a8272f62c6149e66)
Το διβοράνιο(6) είναι πολύ δραστικό και ευέλικτο αντιδραστήριο που έχει ένα μεγάλο αριθμό από χημικές εφαρμογές[16]
1. Το διβοράνιο(6) υδρολύεται δίνοντας υδρογόνο και βορικό οξύ:

2. Το διβοράνιο(6) αντιδρά με αλκοόλες (ROH) δίνοντας τριμεθοξυβορικούς εστέρες [B(OR)3][17]:

3. Με επίδραση αμάγαλματος νατρίου σε διβορανίο(6) σε σηματίζονται νατριοβοριοϋδρίδιο (NaBH4) και Na[B3H8][17]. Όταν υδρίδιο του λιθίου διαλυμένο σε διαιθυλαιθέρα επιδράσει σε διβοράνιο(6) σχηματίζεται λιθιοβοριοϋδρίδιο[17]:

4. Με επίδραση άνυδρου υδραλογόνου (HX, όπου X χλώριο ή βρώμιο) παράγεται το αντίστοιχο αλοδιβοράνιο(5)[17]:

5. Η πιο σημανυική κατηγορία αντιδράσεων είναι η δημιουργία συμπλόκων με βάσεις κατά Lewis. Συχνά τέτοια άμεσα παράγωγα χρησιμοποιούνται για την ταχεία παραγωγή άλλων. Αξιοσημείωτη υποπερίπτωση είναι τα σύμπλοκα με τετραϋδροφουράνιο (THF) και διμεθυλοθειαιθέρα (Me2S), που είναι και οι δυο δημοφιλείς υγρά οργανικά αναγωγικά αντιδραστήρια. Σ' αυτά τα 1:1 σύμπλοκα το βόριο αποκτά τετραεδρική γεωμετρία, ενωμένο τα τρία (3) άτομα υδρογόνου και το άτομο του οξυγόνου του THF ή του θείου του Me2S, αντίστοιχα.

ή

Τα αμφίβολης σταθερότητας σύμπλοκα που λαμβάνονται διατηρούνται σε ατμόαφαιρα αζώτου και σε θερμοκρασία δωματίου (20 °C).
6. Αντιδρά με την αμμωνία (NH3), με την οποία δίνει βοραζάνιο (BH3NH3) ή διβοραδιαζάνιο (Η3ΝΒ2Η6ΝΗ3, DADB), ανάλογα με τις χρησιμοποιούμενες συνθήκες.

ή

7. Το διβοράνιο, δίνει επίσης προϊόντα προσθήκης σε διπλούς ή τριπλούς δεσμούς, που οδηγούν σε παραπέρα αντιδράσεις και παράγωγα. Π.χ.[18]:

8. Το διβοράνιο δρα, ακόμη, ως αναγωγικό αντιδρατήριο, ανάγοντας π.χ. καρβονικά οξέα (RCOOH) στις αντίστοιχες αλκοόλες (RCH2OH):

- ↑ Καταχρηστική ονομασία, αφού το βόριο έχει και άλλα υδρίδια.
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Stock, A. (1933). The Hydrides of Boron and Silicon. New York: Cornell University Press.
- ↑ Bauer, S. H. (1937). "The Structure of Diborane". Journal of the American Chemical Society 59 (6): 1096–1103. doi:10.1021/ja01285a041.
- ↑ Bauer, S. H. (1942). "Structures and Physical Properties of the Hydrides of Boron and of their Derivatives". Chemical Reviews 31 (1): 43–75. doi:10.1021/cr60098a002.
- ↑ Schlesinger, H. I.; Burg, A. B. (1942). "Recent Developments in the Chemistry of the Boron Hydrides". Chemical Reviews 31 (1): 1–41. doi:10.1021/cr60098a001.
- ↑ Longuet-Higgins, H. C.; Bell, R. P. (1943). "64. The Structure of the Boron Hydrides". Journal of the Chemical Society (Resumed) 1943: 250–255. doi:10.1039/JR9430000250. edit
- ↑ Dilthey, W. (1921). "Über die Konstitution des Wassers" (pdf). Angewandte Chemie 34 (95): 596. doi:10.1002/ange.19210349509.
- ↑ Nekrassov, B. V. (1940). Journal of General Chemistry of the USSR 10: 1021.
- ↑ Nekrassov, B. V. (1940). Journal of General Chemistry of the USSR 10: 1056.
- ↑ G. Rasul, G. K. S. Prakash, G. A. Olah (2005). "Comparative ab Initio Study of the Structures and Stabilities of the Ethane Dication C2H62+ and Its Silicon Analogues Si2H62+ and CSiH62+". J. Phys. Chem. A 109 (5): 798–801. doi:10.1021/jp0404652.
- ↑ Laslo P (2000). "A Diborane Story". Angewandte Chemie International Edition 39: 2071–2072. doi:10.1002/1521-3773(20000616)39:12<2071::AID-ANIE2071>3.0.CO;2-C. abstract
- ↑ Andrews, Lester; Wang, Xuefeng (2003). "The Infrared Spectrum of Al2H6 in Solid Hydrogen". Science 299 (5615): 2049–2052. doi:10.1126/science.1082456.
- ↑ Downs, Anthony J.; Colin R. Pulham (1994). "The hydrides of aluminium, gallium, indium and thallium: A re-evaluation". Chemical Society Reviews (Cambridge: Royal Society of Chemistry) 23 (3): 175–184. doi:10.1039/cs9942300175.
- ↑ Norman, A. D.; Jolly, W. L.; Saturnino, D.; Shore, S. G. (1968). "Diborane". Inorganic Syntheses 11: 15–19. doi:10.1002/9780470132425.ch4.
- ↑ Mikhailov, B. M. (1962). "The Chemistry of Diborane". Russian Chemical Reviews 31 (4): 207–224. doi:10.1070/RC1962v031n04ABEH001281.
- ↑ 17,0 17,1 17,2 17,3 Housecroft, C. E.; Sharpe, A. G. (2008). "Chapter 13: The Group 13 Elements". Inorganic Chemistry (3rd ed.). Pearson. p. 336. ISBN 978-0-13-175553-6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.










![{\displaystyle \mathrm {B_{2}O_{3}+2Al+3H_{2}+AlCl_{3}{\xrightarrow[{750\;bar}]{150^{o}C}}B_{2}H_{6}+3AlOCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c527ebf15c840f2669feba97a8272f62c6149e66)









