この
記事 きじ は
英語 えいご 版 ばん 対応 たいおう 翻訳 ほんやく 充実 じゅうじつ (2021年 ねん 月 がつ ) 翻訳 ほんやく 前 まえ 重要 じゅうよう 指示 しじ 読 よ 右 みぎ 表示 ひょうじ
英語 えいご 版 ばん 記事 きじ 日本語 にほんご 機械 きかい 翻訳 ほんやく 翻訳 ほんやく 万 まん 一 いち 翻訳 ほんやく 手 て 機械 きかい 翻訳 ほんやく 用 もち 場合 ばあい 翻訳 ほんやく 者 しゃ 必 かなら 翻訳 ほんやく 元 もと 原文 げんぶん 参照 さんしょう 機械 きかい 翻訳 ほんやく 誤 あやま 訂正 ていせい 正確 せいかく 翻訳 ほんやく 成 な 場合 ばあい 記事 きじ 削除 さくじょ 方針 ほうしん G-3 に基 もと 削除 さくじょ 可能 かのう 性 せい 信頼 しんらい 性 せい 低 ひく 低 てい 品質 ひんしつ 文章 ぶんしょう 翻訳 ほんやく 可能 かのう 文章 ぶんしょう 他 た 言語 げんご 版 ばん 記事 きじ 示 しめ 文献 ぶんけん 正 ただ 確認 かくにん 履歴 りれき 継承 けいしょう 行 おこな 要約 ようやく 欄 らん 翻訳 ほんやく 元 もと 記事 きじ 名 めい 版 ばん 記述 きじゅつ 必要 ひつよう 記述 きじゅつ 方法 ほうほう Wikipedia:翻訳 ほんやく 要約 ようやく 欄 らん 記入 きにゅう を参照 さんしょう 翻訳 ほんやく 後 ご {{翻訳 ほんやく 告知 こくち をノート に追加 ついか Wikipedia:翻訳 ほんやく に、より詳細 しょうさい 翻訳 ほんやく 手順 てじゅん 指針 ししん 説明 せつめい
プロテアソーム (proteasome) はタンパク質 たんぱくしつ 分解 ぶんかい 行 おこな 巨大 きょだい 酵素 こうそ 複 ふく 合体 がったい 真 ま 核 かく 生物 せいぶつ 細胞 さいぼう 細胞 さいぼう 質 しつ 核 かく 内 うち 分布 ぶんぷ [1] ユビキチン により標識 ひょうしき タンパク質 たんぱくしつ 分解 ぶんかい 系 けい ユビキチン-プロテアソームシステム と呼 よ 細胞 さいぼう 周期 しゅうき 制御 せいぎょ 免疫 めんえき 応答 おうとう シグナル伝達 でんたつ といった細胞 さいぼう 中 ちゅう 様々 さまざま 働 はたら 関 かか 機構 きこう 介 かい タンパク質 たんぱくしつ 分解 ぶんかい 発見 はっけん 功績 こうせき アーロン・チカノーバー 、アブラム・ハーシュコ 、アーウィン・ローズ の3人 にん 2004年 ねん ノーベル化学 かがく 賞 しょう を受賞 じゅしょう
プロテアソームは全 すべ 真 ま 核 かく 生物 せいぶつ 古 こ 細菌 さいきん 有 ゆう 古 こ 細菌 さいきん 真 ま 核 かく 生物 せいぶつ 比 くら 単純 たんじゅん 本稿 ほんこう 主 おも 真 ま 核 かく 生物 せいぶつ 解説 かいせつ
両 りょう 端 はし 複 ふく 合体 がったい 結合 けつごう 26Sプロテアソームは、プロテアーゼ 活性 かっせい 有 ゆう 筒 つつ 状 じょう 蓋 ぶた 役割 やくわり 果 は 複 ふく 合体 がったい 結合 けつごう 型 がた 呼 よ 対 たい 両 りょう 端 はし 複 ふく 合体 がったい 結合 けつごう 型 がた 呼 よ
20Sプロテアソーム (CP:core particle) 20Sプロテアソームはα あるふぁ 分子 ぶんし 構成 こうせい α あるふぁ β べーた 分子 ぶんし 構成 こうせい β べーた 順 じゅん 積 つ 重 かさ 筒 つつ 状 じょう 構造 こうぞう 空洞 くうどう 部分 ぶぶん タンパク質 たんぱくしつ 分解 ぶんかい 場 ば β べーた β べーた β べーた トリプシン 様 よう キモトリプシン 様 よう 加水 かすい 分解 ぶんかい 活性 かっせい 異 こと 触媒 しょくばい 活性 かっせい 発揮 はっき [2] 通常 つうじょう 単体 たんたい 状態 じょうたい α あるふぁ 閉 と 基質 きしつ 中 なか 入 はい 分子 ぶんし 集合 しゅうごう 分子 ぶんし 正 まさ 形成 けいせい 19S複 ふく 合体 がったい 筒 つつ 状 じょう 両 りょう 端 はし 結合 けつごう 蓋 ぶた 役割 やくわり 果 は 複 ふく 合体 がったい 基部 きぶ 蓋 ぶた 部 ぶ 分 わ 計 けい 分子 ぶんし タンパク質 たんぱくしつ 構成 こうせい α あるふぁ 開口 かいこう 制御 せいぎょ 標的 ひょうてき タンパク質 たんぱくしつ 関 かか 計 けい 分子 ぶんし タンパク質 たんぱくしつ 構成 こうせい 脱 だつ 化 か 反応 はんのう 関 かか 目 め 蝶番 ちょうつがい 的 てき 役割 やくわり 並 なら 標的 ひょうてき タンパク質 たんぱくしつ 認識 にんしき 捕捉 ほそく 関 かか 11S複 ふく 合体 がったい 上記 じょうき 複 ふく 合体 がったい 同様 どうよう 両 りょう 端 はし 結合 けつごう 能力 のうりょく 有 ゆう 量 りょう 体 たい 活性 かっせい 有 ゆう 含 ふく 短 みじか 分解 ぶんかい 寄与 きよ 免疫 めんえき [ 編集 へんしゅう ] ウイルス感染 かんせん IFNγ がんま が産 さん 生 む 応答 おうとう β べーた β べーた β べーた 種類 しゅるい サブユニット が誘導 ゆうどう β べーた β べーた β べーた 入 い 替 か 活性 かっせい 部位 ぶい 入 い 替 か 免疫 めんえき 呼 よ 形成 けいせい
また、IFNγ がんま 複 ふく 合体 がったい 誘導 ゆうどう 複 ふく 合体 がったい 複 ふく 合体 がったい 同様 どうよう 結合 けつごう 分解 ぶんかい 断片 だんぺん 排出 はいしゅつ 促進 そくしん 役割 やくわり 考 かんが 複 ふく 合体 がったい 免疫 めんえき 複 ふく 合体 がったい 形成 けいせい MHCクラスI により抗原 こうげん 提示 ていじ 際 さい 都合 つごう 良 よ 断片 だんぺん 生 しょう 考 かんが
タンパク質 たんぱくしつ 分解 ぶんかい [ 編集 へんしゅう ] ユビキチン-プロテアソームシステムの大 おお 流 なが [ 編集 へんしゅう ] ユビキチンの基質 きしつ 結合 けつごう 標的 ひょうてき タンパク質 たんぱくしつ 標識 ひょうしき 詳 くわ ユビキチン を参照 さんしょう 標的 ひょうてき タンパク質 たんぱくしつ 結合 けつごう 鎖 くさり 複 ふく 合体 がったい 結合 けつごう 標的 ひょうてき タンパク質 たんぱくしつ 鎖 くさり 切 き 離 はな 切 き 離 はな 再 さい 利用 りよう 標的 ひょうてき タンパク質 たんぱくしつ 立体 りったい 構造 こうぞう 解 と 内 ない 送 おく 込 こ β べーた 内部 ないぶ 活性 かっせい 標的 ひょうてき タンパク質 たんぱくしつ 分解 ぶんかい ユビキチン非 ひ 依存 いぞん 的 てき タンパク質 たんぱくしつ 分解 ぶんかい [ 編集 へんしゅう ] プロテアソームによるタンパク質 たんぱくしつ 分解 ぶんかい 場合 ばあい 標識 ひょうしき 必要 ひつよう 必 かなら 例外 れいがい 最 もっと 知 し 分子 ぶんし オルニチンデカルボキシラーゼ (ODC)である[3] 細胞 さいぼう 周期 しゅうき 制御 せいぎょ 関与 かんよ 非 ひ 依存 いぞん 性 せい 分解 ぶんかい 経路 けいろ 存在 そんざい 分子 ぶんし 依存 いぞん 的 てき 分解 ぶんかい 行 おこな [4]
プロテアソームによる分解 ぶんかい 意義 いぎ [ 編集 へんしゅう ] プロテアソームと同 おな 細胞 さいぼう 内 ない 蛋白質 たんぱくしつ 分解 ぶんかい 司 つかさど リソソーム が知 し 蛋白質 たんぱくしつ 分解 ぶんかい 他 た 新 あたら 蛋白質 たんぱくしつ 合成 ごうせい 材料 ざいりょう 供給 きょうきゅう 目的 もくてき 対 たい 目的 もくてき 蛋白質 たんぱくしつ 特異 とくい 的 てき 分解 ぶんかい 細胞 さいぼう 内 ない 除去 じょきょ 目的 もくてき
プロテアソームを介 かい 細胞 さいぼう 周期 しゅうき 伝達 でんたつ 制御 せいぎょ [ 編集 へんしゅう ] プロテアソームは細胞 さいぼう 周期 しゅうき 伝達 でんたつ 制御 せいぎょ 重要 じゅうよう 役割 やくわり 果 は 以下 いか 具体 ぐたい 例 れい 示 しめ
Nuclear factor κ かっぱ κ かっぱ 経路 けいろ 活性 かっせい 化 か [ 編集 へんしゅう ] 転写 てんしゃ 因子 いんし NF-κ かっぱ は炎症 えんしょう 関連 かんれん 遺伝子 いでんし 活性 かっせい 化 か 関与 かんよ タンパク質 たんぱくしつ アミノ酸 あみのさん 配列 はいれつ 中 ちゅう 核 かく 内 ない 移行 いこう 有 ゆう 通常 つうじょう κ かっぱ κ かっぱ 細胞 さいぼう 質 しつ 保持 ほじ 何 なん 刺激 しげき 炎症 えんしょう 性 せい 刺激 しげき 酸化 さんか ストレス 等 ひとし 細胞 さいぼう 入 はい κ かっぱ 酸化 さんか 生 しょう κ かっぱ 系 けい 介 かい 分解 ぶんかい 受 う 外 はず κ かっぱ 核 かく 内 ない 移行 いこう 後 のち 相互 そうご 作用 さよう 転写 てんしゃ 亢進 こうしん 行 おこな
細胞 さいぼう 周期 しゅうき 関与 かんよ [ 編集 へんしゅう ] 細胞 さいぼう 周期 しゅうき 回転 かいてん サイクリン とサイクリン依存 いぞん 性 せい (CDK;cyclin dependent kinase)の複 ふく 合体 がったい 重要 じゅうよう 役割 やくわり 担 にな 細胞 さいぼう 周期 しゅうき 回転 かいてん G1 →S →G2 →M期 き の順 じゅん 進行 しんこう 例 たと 進行 しんこう サイクリンE /CDK2 が寄与 きよ 期 き 発現 はつげん 上昇 じょうしょう 細胞 さいぼう 周期 しゅうき 回転 かいてん 進 すす 期 き 入 はい 酸化 さんか 受 う 分解 ぶんかい 受 う 知 し
また、上記 じょうき 反対 はんたい 活性 かっせい 阻害 そがい 細胞 さいぼう 周期 しゅうき 負 まけ 制御 せいぎょ p21 、p27 など)も、プロテアソーム依存 いぞん 的 てき 分解 ぶんかい 発現 はつげん 量 りょう 制御 せいぎょ 受 う 多 おお 協調 きょうちょう 細胞 さいぼう 周期 しゅうき 秩序 ちつじょ 進行 しんこう 機構 きこう 制御 せいぎょ 重要 じゅうよう 役割 やくわり 担 にな
細胞 さいぼう 周期 しゅうき 回転 かいてん 関与 かんよ ユビキチンリガーゼ としてAPC/C (anaphase-promoting complex/cyclosome)とSCF(Skp1-cullin-F-box)が知 し 大 だい 期 き 細胞 さいぼう 周期 しゅうき 回転 かいてん 関与 かんよ 他 た 時期 じき 関与 かんよ 抑制 よくせい 働 はたら 分解 ぶんかい MDM2 (murine double minute2)が関与 かんよ
HIF-1α あるふぁ 分解 ぶんかい [ 編集 へんしゅう ] 転写 てんしゃ 因子 いんし 低 てい 酸素 さんそ 誘導 ゆうどう 因子 いんし α あるふぁ 低 てい 酸素 さんそ 状態 じょうたい 誘導 ゆうどう 蛋白質 たんぱくしつ α あるふぁ 誘導 ゆうどう 型 がた 一酸化 いっさんか 窒素 ちっそ 合成 ごうせい 酵素 こうそ 血管 けっかん 内皮 ないひ 増殖 ぞうしょく 因子 いんし 等 とう 転写 てんしゃ 促進 そくしん 関与 かんよ 癌 がん 血管 けっかん 新生 しんせい 関与 かんよ 正常 せいじょう 酸素 さんそ 状態 じょうたい α あるふぁ プロリン 残 ざん 基 もと 水酸化 すいさんか 受 う 分解 ぶんかい 導 みちび
古 こ 細菌 さいきん [ 編集 へんしゅう ] 現在 げんざい 調 しら 全 すべ 古 こ 細菌 さいきん 持 も 最初 さいしょ 構造 こうぞう 決定 けってい 真 ま 核 かく 生物 せいぶつ 古 こ 細菌 さいきん T. acidopilum のものであった。真 ま 核 かく 生物 せいぶつ 同様 どうよう タンパク質 たんぱくしつ 分解 ぶんかい 担 にな 遺伝子 いでんし 一部 いちぶ 古 こ 細菌 さいきん 見出 みいだ 実態 じったい 不明 ふめい
大 おお 構造 こうぞう 真 ま 核 かく 生物 せいぶつ 型 がた 同一 どういつ 構造 こうぞう 単純 たんじゅん α あるふぁ 分子 ぶんし 量 りょう 体 たい 構成 こうせい α あるふぁ β べーた 分子 ぶんし 量 りょう 体 たい 構成 こうせい β べーた α あるふぁ β べーた β べーた α あるふぁ 層 そう 重 かさ 構造 こうぞう 持 も 分子 ぶんし 蓋 ぶた 部 ぶ 備 そな α あるふぁ β べーた β べーた α あるふぁ 様 よう 構造 こうぞう 明 あき
なお、真正 しんしょう 細菌 さいきん 目 め 古 こ 細菌 さいきん 似 に 有 ゆう 目 め 真正 しんせい 細菌 さいきん タンパク質 たんぱくしつ 分解 ぶんかい 同時 どうじ 備 そな 真正 しんせい 細菌 さいきん 中 なか 目 め 持 も 不明 ふめい 結核 けっかく 菌 きん 病原 びょうげん 性 せい 関与 かんよ 示 しめ
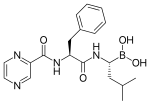
プロテアソーム阻害 そがい 薬 やく [ 編集 へんしゅう ] ボルテゾミブの構造 こうぞう 26Sプロテアソームを阻害 そがい ボルテゾミブ が、血液 けつえき 癌 がん 一種 いっしゅ 多発 たはつ 性 せい 骨髄腫 こつづいしゅ 有効 ゆうこう 報告 ほうこく 抗癌剤 こうがんざい 臨床 りんしょう 応用 おうよう [5]
^ Peters JM, Franke WW and Kleinschmidt JA.(1994)"Distinct 19S and 20S subcomplexes of the 26S proteasome and their distribution in the nucleus and the cytoplasm."J.Biol.Chem. 269 ,7709–18. PMID 8125997
^ Heinemeyer W, Fischer M, Krimmer T, Stachon U and Wolf DH.(1997)"The active sites of the eukaryotic 20 S proteasome and their involvement in subunit precursor processing."J.Biol.Chem. 272 ,25200–9. PMID 9312134
^ Zhang M and Coffino P.(2004)"Repeat sequence of Epstein-Barr virus-encoded nuclear antigen 1 protein interrupts proteasome substrate processing."J.Biol.Chem. 279 ,8635–41. PMID 14688254
^ Asher G and Shaul Y.(2005)"p53 proteasomal degradation: poly-ubiquitination is not the whole story."Cell Cycle. 4 ,1015–8. PMID 16082197
^ Fisher RI, Bernstein SH, Kahl BS, Djulbegovic B, Robertson MJ, de Vos S, Epner E, Krishnan A, Leonard JP, Lonial S, Stadtmauer EA, O'Connor OA, Shi H, Boral AL and Goy A.(2006)"Multicenter phase II study of bortezomib in patients with relapsed or refractory mantle cell lymphoma."J.Clin.Oncol. 24 ,4867–74. PMID 17001068