ERBB3
ERBB3(v-erb-b2 avian erythroblastic leukemia viral oncogene homolog 3、ErbB3)またはHER3(human epidermal growth factor receptor 3)は、ヒトではERBB3
ErbB3は
遺伝子 と発現
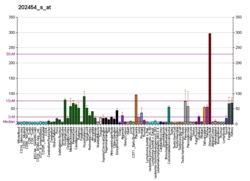
[ヒトのERBB3
ヒトの
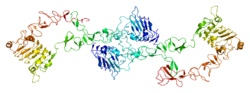
構造
[ErbB3は
リガンドを
機能
[ErbB3はヘレグリン[10]やNRG2[11]をリガンドとして
リガンド
ErbB2との相互 作用
[ErbB2-ErbB3
PI3K/Akt経路 の活性 化
[ErbB3の
がんにおける役割
[ErbB3の
ErbB3は
- HER2+
乳 がんにおけるHER2阻害 薬 耐 性 [21] - ER+
乳 がんにおける抗 エストロゲン療法 耐 性 [22][23] 肺 がんや頭 頸部がんにおけるEGFR阻害 薬 耐 性 [24][25]前立腺 がんにおけるホルモン療法 耐 性 [26]肝 細胞 がんにおけるIGF1R阻害 薬 耐 性 [27]- メラノーマにおけるBRAF
阻害 薬 耐 性 [28]
ErbB2の
正常 な発生 における役割
[ERBB3は
また、ErbB3は
出典
[- ^ a b c GRCh38: Ensembl release 89: ENSG00000065361 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000018166 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “ERBB3 Gene – GeneCards | ERBB3 Protein”. 2023
年 8月 11日 閲覧 。 - ^ “Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene”. Science 230 (4730): 1132–9. (1985). Bibcode: 1985Sci...230.1132C. doi:10.1126/science.2999974. PMID 2999974.
- ^ “Expression of the c-erbB-3 protein in normal human adult and fetal tissues”. Oncogene 7 (7): 1273–8. (1992). PMID 1377811.
- ^ “Structure of the extracellular region of HER3 reveals an interdomain tether”. Science 297 (5585): 1330–3. (2002). Bibcode: 2002Sci...297.1330C. doi:10.1126/science.1074611. PMID 12154198.
- ^ a b c Roskoski R (2014). “The ErbB/HER family of protein-tyrosine kinases and cancer”. Pharmacol. Res. 79: 34–74. doi:10.1016/j.phrs.2013.11.002. PMID 24269963.
- ^ “The erbB3 gene product is a receptor for heregulin”. J. Biol. Chem. 269 (19): 14303–6. (1994). doi:10.1016/S0021-9258(17)36789-3. PMID 8188716.
- ^ “Neuregulin-2, a new ligand of ErbB3/ErbB4-receptor tyrosine kinases”. Nature 387 (6632): 512–6. (1997). Bibcode: 1997Natur.387R.512C. doi:10.1038/387512a0. PMID 9168115.
- ^ “ErbB3/HER3 intracellular domain is competent to bind ATP and catalyze autophosphorylation”. Proc. Natl. Acad. Sci. U.S.A. 107 (17): 7692–7. (2010). Bibcode: 2010PNAS..107.7692S. doi:10.1073/pnas.1002753107. PMC 2867849. PMID 20351256.
- ^ “A hierarchical network of interreceptor interactions determines signal transduction by Neu differentiation factor/neuregulin and epidermal growth factor”. Mol. Cell. Biol. 16 (10): 5276–87. (1996). doi:10.1128/MCB.16.10.5276. PMC 231527. PMID 8816440.
- ^ a b c “The deaf and the dumb: the biology of ErbB-2 and ErbB-3”. Exp. Cell Res. 284 (1): 54–65. (2003). doi:10.1016/s0014-4827(02)00101-5. PMID 12648465.
- ^ “The oncogenic ErbB-2/ErbB-3 heterodimer is a surrogate receptor of the epidermal growth factor and betacellulin”. Oncogene 16 (10): 1249–58. (1998). doi:10.1038/sj.onc.1201642. PMID 9546426.
- ^ “Epidermal growth factor and betacellulin mediate signal transduction through co-expressed ErbB2 and ErbB3 receptors”. EMBO J. 16 (18): 5608–17. (1997). doi:10.1093/emboj/16.18.5608. PMC 1170193. PMID 9312020.
- ^ “Identification of c-erbB-3 binding sites for phosphatidylinositol 3'-kinase and SHC using an EGF receptor/c-erbB-3 chimera”. EMBO J. 13 (12): 2831–41. (1994). doi:10.1002/j.1460-2075.1994.tb06577.x. PMC 395164. PMID 8026468.
- ^ “Transformation of NIH 3T3 cells by HER3 or HER4 receptors requires the presence of HER1 or HER2”. J. Biol. Chem. 271 (7): 3884–90. (1996). doi:10.1074/jbc.271.7.3884. PMID 8632008.
- ^ “The ErbB2/ErbB3 heterodimer functions as an oncogenic unit: ErbB2 requires ErbB3 to drive breast tumor cell proliferation”. Proc. Natl. Acad. Sci. U.S.A. 100 (15): 8933–8. (2003). Bibcode: 2003PNAS..100.8933H. doi:10.1073/pnas.1537685100. PMC 166416. PMID 12853564.
- ^ a b “Elevated expression of erbB3 confers paclitaxel resistance in erbB2-overexpressing breast cancer cells via upregulation of Survivin”. Oncogene 29 (29): 4225–36. (2010). doi:10.1038/onc.2010.180. PMID 20498641.
- ^ “Escape from HER-family tyrosine kinase inhibitor therapy by the kinase-inactive HER3”. Nature 445 (7126): 437–41. (2007). Bibcode: 2007Natur.445..437S. doi:10.1038/nature05474. PMC 3025857. PMID 17206155.
- ^ “Role for HER2/neu and HER3 in fulvestrant-resistant breast cancer”. Int. J. Oncol. 30 (2): 509–20. (2007). doi:10.3892/ijo.30.2.509. PMID 17203234.
- ^ “Loss of Phosphatase and Tensin homologue deleted on chromosome 10 engages ErbB3 and insulin-like growth factor-I receptor signaling to promote antiestrogen resistance in breast cancer”. Cancer Res. 69 (10): 4192–201. (2009). doi:10.1158/0008-5472.CAN-09-0042. PMC 2724871. PMID 19435893.
- ^ “MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling”. Science 316 (5827): 1039–43. (2007). Bibcode: 2007Sci...316.1039E. doi:10.1126/science.1141478. PMID 17463250.
- ^ “Signaling via ErbB2 and ErbB3 associates with resistance and epidermal growth factor receptor (EGFR) amplification with sensitivity to EGFR inhibitor gefitinib in head and neck squamous cell carcinoma cells”. Clin. Cancer Res. 12 (13): 4103–11. (2006). doi:10.1158/1078-0432.CCR-05-2404. PMID 16818711.
- ^ “EBP1, an ErbB3-binding protein, is decreased in prostate cancer and implicated in hormone resistance”. Mol. Cancer Ther. 7 (10): 3176–86. (2008). doi:10.1158/1535-7163.MCT-08-0526. PMC 2629587. PMID 18852121.
- ^ “Insulin-like growth factor-1 receptor inhibition induces a resistance mechanism via the epidermal growth factor receptor/HER3/AKT signaling pathway: rational basis for cotargeting insulin-like growth factor-1 receptor and epidermal growth factor receptor in hepatocellular carcinoma”. Clin. Cancer Res. 15 (17): 5445–56. (2009). doi:10.1158/1078-0432.CCR-08-2980. PMID 19706799.
- ^ Kugel, C. H.; Hartsough, E. J.; Davies, M. A.; Setiady, Y. Y.; Aplin, A. E. (July 17, 2014). “Function-Blocking ERBB3 Antibody Inhibits the Adaptive Response to RAF Inhibitor”. The Journal of Cancer Research 74 (15): 4122–4132. doi:10.1158/0008-5472.CAN-14-0464. PMC 4120074. PMID 25035390.
- ^ “Severe neuropathies in mice with targeted mutations in the ErbB3 receptor”. Nature 389 (6652): 725–30. (1997). Bibcode: 1997Natur.389..725R. doi:10.1038/39593. PMID 9338783.
- ^ Britsch, S; Li, L; Kirchhoff, S; Theuring, F; Brinkmann, V; Birchmeier, C; Riethmacher, D (1998). “The ErbB2 and ErbB3 receptors and their ligand, neuregulin-1, are essential for development of the sympathetic nervous system.”. Genes & Development 12 (12): 1825–36. doi:10.1101/gad.12.12.1825. PMC 316903. PMID 9637684.
- ^ Davies AM (1998). “Neuronal survival: early dependence on Schwann cells”. Curr. Biol. 8 (1): R15–8. doi:10.1016/s0960-9822(98)70009-0. PMID 9427620.
関連 文献
[- “Neuregulin 1-erbB signaling and the molecular/cellular basis of schizophrenia”. Nat. Neurosci. 7 (6): 575–80. (2004). doi:10.1038/nn1258. PMID 15162166.
- “Molecular cloning and expression of an additional epidermal growth factor receptor-related gene”. Proc. Natl. Acad. Sci. U.S.A. 87 (13): 4905–9. (1990). Bibcode: 1990PNAS...87.4905P. doi:10.1073/pnas.87.13.4905. PMC 54229. PMID 2164210.
- “Isolation and characterization of ERBB3, a third member of the ERBB/epidermal growth factor receptor family: evidence for overexpression in a subset of human mammary tumors”. Proc. Natl. Acad. Sci. U.S.A. 86 (23): 9193–7. (1990). doi:10.1073/pnas.86.23.9193. PMC 298460. PMID 2687875.
- “Cooperative signaling of ErbB3 and ErbB2 in neoplastic transformation and human mammary carcinomas”. Oncogene 10 (9): 1813–21. (1995). PMID 7538656.
- “Heregulin-dependent regulation of HER2/neu oncogenic signaling by heterodimerization with HER3”. EMBO J. 14 (17): 4267–75. (1995). doi:10.1002/j.1460-2075.1995.tb00101.x. PMC 394510. PMID 7556068.
- “Binding of Neu differentiation factor with the extracellular domain of Her2 and Her3”. J. Biol. Chem. 270 (41): 24604–8. (1995). doi:10.1074/jbc.270.41.24604. PMID 7592681.
- “Prognostic significance of ERBB3 overexpression in oral squamous cell carcinoma”. Cancer Lett. 95 (1–2): 79–83. (1995). doi:10.1016/0304-3835(95)03866-U. PMID 7656248.
- “c-erbB3 gene encodes secreted as well as transmembrane receptor tyrosine kinase”. Biochem. Biophys. Res. Commun. 192 (3): 1189–97. (1993). doi:10.1006/bbrc.1993.1542. PMID 7685162.
- “Characterization of a breast cancer cell differentiation factor that specifically activates the HER4/p180erbB4 receptor”. J. Biol. Chem. 268 (25): 18407–10. (1993). doi:10.1016/S0021-9258(17)46636-1. PMID 7689552.
- “High expression of the EGFR in fibroadenomas compared to breast carcinomas”. Anticancer Res. 14 (5A): 1679–88. (1995). PMID 7847801.
- “Expression of c-erbB family gene products in adenoid cystic carcinoma of salivary glands: an immunohistochemical study”. Anticancer Res. 15 (6B): 2623–6. (1996). PMID 8669836.
- “Ligands for ErbB-family receptors encoded by a neuregulin-like gene”. Nature 387 (6632): 509–12. (1997). Bibcode: 1997Natur.387R.509C. doi:10.1038/387509a0. PMID 9168114.
- “Analysis of Grb7 recruitment by heregulin-activated erbB receptors reveals a novel target selectivity for erbB3”. J. Biol. Chem. 273 (13): 7717–24. (1998). doi:10.1074/jbc.273.13.7717. PMID 9516479.
- “Binding interaction of the heregulinbeta egf domain with ErbB3 and ErbB4 receptors assessed by alanine scanning mutagenesis”. J. Biol. Chem. 273 (19): 11667–74. (1998). doi:10.1074/jbc.273.19.11667. PMID 9565587.
- “Isolation and characterization of four alternate c-erbB3 transcripts expressed in ovarian carcinoma-derived cell lines and normal human tissues”. Oncogene 16 (25): 3243–52. (1998). doi:10.1038/sj.onc.1201866. PMID 9681822.
- “Mutation of a Shc binding site tyrosine residue in ErbB3/HER3 blocks heregulin-dependent activation of mitogen-activated protein kinase”. J. Biol. Chem. 273 (33): 20996–1002. (1998). doi:10.1074/jbc.273.33.20996. PMID 9694850.
- “Interaction of the p23/p198 protein with ErbB-3”. Gene 229 (1–2): 215–21. (1999). doi:10.1016/S0378-1119(98)00604-0. PMID 10095121.
- “The phosphatidylinositol 3'-kinase pathway is a dominant growth factor-activated cell survival pathway in LNCaP human prostate carcinoma cells”. Cancer Res. 59 (12): 2891–7. (1999). PMID 10383151.