维基百科 ひゃっか 自由 じゆう 的 てき 百科 ひゃっか 全 ぜん
曼尼希 まれ 反 はん (Mannich反 はん ,简称曼氏反 はん ),也称作 さく 胺甲基 もと 化 か 反 はん ,是 ぜ 含有 がんゆう 活 かつ 的 てき 化合 かごう 物 ぶつ 通常 つうじょう 羰基化合 かごう 物 ぶつ )与 あずか 甲 きのえ 和 わ 二 に 胺 或 ある 氨 缩合,生成 せいせい β べーた 化合 かごう 物 ぶつ 的 てき 有 ゆう 机 つくえ 化学 かがく 反 はん 一般 いっぱん 亚胺 与 あずか α あるふぁ 基 もと 化合 かごう 物的 ぶってき 反 はん 被 ひ 看 み 尼 あま 希 まれ 反 はん 反 はん β べーた 化合 かごう 物 ぶつ 称 しょう 曼尼希 まれ ”(Mannich碱),简称曼氏碱 。
曼尼希 まれ 反 はん 二 に 甲 きのえ α あるふぁ 化合 かごう 物 ぶつ 生成 せいせい β べーた 化合 かごう 物 ぶつ 反 はん 的 てき 二 に 哌啶 、二 に 甲 かぶと 等 ひとし 用 よう 一 いち 反 はん 的 てき 在 ざい 可 か 生 せい 反 はん 故 こ 有 ゆう 可 か 根 ね 据 すえ 需要 じゅよう 使用 しよう 一 いち 用 よう 三 さん 或 ある 芳香 ほうこう 反 はん 生成 せいせい 停留 ていりゅう 在 ざい 季 き 子 こ 一 いち 步 ほ
胺/氨的作用 さよう 是 ぜ 活 かつ 化 か 甲 きのえ 是 ぜ 最 さい 常用 じょうよう 的 てき 一般 いっぱん 用 よう 水溶液 すいようえき 三 さん 或 ある 多 た 除 じょ 甲 かぶと 用 よう 反 はん 一般 いっぱん 在 ざい 水 みず 乙 おつ 酸 す 或 ある 醇 あつし 中 ちゅう 加入 かにゅう 少量 しょうりょう 盐酸 以保证酸性 せい
含α あるふぁ 化合 かごう 物 ぶつ 一 いち 羰基化合 かごう 物 ぶつ (醛 、酮 、羧酸 、酯 )、腈 、脂肪 しぼう 硝基化合 かごう 物 ぶつ 、末端 まったん 炔烃 、α あるふぁ 吡啶 或 ある 亚胺 等 ひとし 若 わか 用 よう 不 ふ 的 てき 物 ぶつ 是 ぜ 混合 こんごう 物 ぶつ 呋喃 、吡咯 、噻吩 等 ひとし 杂环化合 かごう 物 ぶつ 也可反 はん
曼氏反 はん 通常 つうじょう 高温 こうおん 下和 したお 质子溶剂 中 ちゅう 反 はん 容易 ようい 生成 せいせい 副 ふく
早 はや 在 ざい 年 ねん 便 びん 有人 ゆうじん 酚 作 さく 酸 さん 的 てき 希 まれ [ 1] 之 これ 后 きさき [ 2] 等 とう 人 じん 了 りょう 的 てき 希 まれ 反 はん 包括 ほうかつ 硝基烷 和 かず 伯 はく 硝胺 作 さく 酸 さん 的 てき 反 はん 但 ただし 都 と 没 ぼつ 有意 ゆうい 反 はん 具有 ぐゆう 的 てき 普遍 ふへん 意 い 年 ねん 卡尔·曼尼希 まれ 用 よう 沙 すな 利 り 比 ひ 林 りん 和 わ 乌洛托 たく 品 ひん 反 はん 得 とく 到 いた 了 りょう 物的 ぶってき 在 ざい [ 3] 了 りょう 他 た 甲 きのえ 反 はん 行 ぎょう 了 りょう 深入 ふかいり 的 てき 研究 けんきゅう 了 りょう 希 まれ 反 はん 基 もと 生物 せいぶつ 都 みやこ 是 ただし 通 どおり 尼 あま 希 まれ 反 はん 合成 ごうせい 的 てき
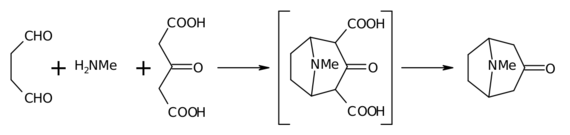
曼尼希 まれ 托 たく 品 ひん 的 てき 合成 ごうせい 是 ぜ 希 まれ 反 はん 例 れい 子 こ 被 ひ 是 ぜ 全 ぜん 合成 ごうせい 中 なか 的 てき 反 はん 一 いち 年 ねん 首 くび 先 さき 合成 ごうせい 了 りょう 化合 かごう 物 ぶつ 用 よう 的 てき 是 ぜ 环庚酮 作原 さくはら 料 りょう 通 つう 步 ほ 反 はん 率 りつ 年 ねん 羅 ら 伯 はく 特 とく 遜 へりくだ 丁 ひのと 二 に 甲 きのえ 和 わ 3-氧代戊 つちのえ 二 に 酸 さん 为原料 りょう 在 ざい 条件下 じょうけんか 利用 りよう 了 りょう 希 まれ 反 はん [ 4] 反 はん 初 はつ 始 はじめ 后 きさき 增 ぞう 至 いたり [ 5] 反 はん 意 い 机 つくえ 理 り [1] (页面存 そん ,存 そん 互联网档案 あん )。
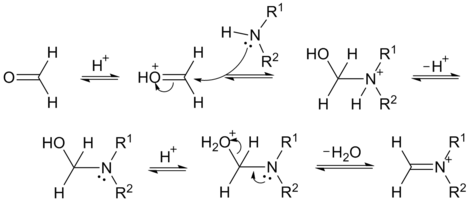
Robinson 托 たく 品 ひん 合成 ごうせい 反 はん 机 つくえ 理 り 示 しめせ 化 か 亲核加 か 成 なり ,去 さ 的 てき 水 みず 可 か 到 いた 一 いち 亚胺离子 中 ちゅう 二 に 甲 かぶと 作原 さくはら 料 りょう 中 ちゅう N ,N -二 に 甲 きのえ 基 はじめ 基 もと 在 ざい 年代 ねんだい 由 ゆかり 等 とう 人 じん 首 くび 先 さき 具有 ぐゆう 的 てき 反 はん 可 か 在 ざい 通常 つうじょう 条件下 じょうけんか 的 てき 反 はん 利 り
亚胺离子作 さく 亲电试剂 ,进攻含活泼氢化合 かごう 物 ぶつ 的 てき 烯醇 型 かた 失 しつ 去 さ 便 びん 得 え 到 いた
曼尼希 まれ 反 はん 理 り 曼尼希 まれ 反 はん 理 り 曼氏碱 比 ひ 定 じょう 作 さく 原料 げんりょう 甲 きのえ 基 はじめ 化 か 与 あずか Hofmann消 しょう 除 じょ 反 はん ,或 ある 在 ざい 蒸 ふけ 和 わ 用 よう 下 か 的 てき 分解 ぶんかい 反 はん 可 か 到 いた α あるふぁ β べーた 不 ふ 后 きさき 者 しゃ 可 か 麦 むぎ 克 かつ 成 なり 等 ひとし 反 はん 是 ぜ 用 よう 的 てき 合成 ごうせい 前 ぜん 体 からだ 但 ただし 由 よし 一般 いっぱん 不 ふ 容易 ようい 故 こ 通常 つうじょう 采 さい 用 よう 分解 ぶんかい 生成 せいせい 不 ふ 在原 ありはら 位 い 与 あずか 反 はん
曼尼希 まれ 反 はん 原 はら 手性 てしょう 原子 げんし 因 いん 物 ぶつ 是 ぜ 对映异构体 たい 。可 か 性 せい 使 つかい 反 はん 成立 せいりつ 体 たい 性 せい 的 てき 首 くび 希 まれ 反 はん 年 ねん 是 ぜ 脯氨酸 さん 作 さく 手性 てしょう 的 てき 反 はん 示 しめせ 反 はん 的 てき 取 と 代 だい 基 もと 越 えつ 大 だい 型 がた 的 てき 比例 ひれい 越 えつ 大 だい [ 6] [2] (页面存 そん ,存 そん 互联网档案 あん )。
不 ふ 反 はん
^ DRP, 89979; 90907 (1895); 90909 (1896).
^ Van Marle, C. M.; Tollens, B., Ber. dtsch. Chem. Ges. , 36 , 1351 (1903).
^ Mannich, C.; Krosche, W. Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin. Archiv der Pharmazie. 1912, 250 : 647–667. doi:10.1002/ardp.19122500151 ^ Arthur J. Birch. Investigating a Scientific Legend: The Tropinone Synthesis of Sir Robert Robinson, F.R.S. Notes and Records of the Royal Society of London , 1993 , 47 , 277-296.
^ Smit, W. et al. (1998) Organic Synthesis, The Science behind the Art. Cambridge: The Royal Society of Chemistry.
^ Cordova, A.; Watanabe, S.; Tanaka, F.; Notz, W.; Barbas, C. F., III. A Highly Enantioselective Route to Either Enantiomer of Both α あるふぁ β べーた Journal of the American Chemical Society . 2002, 124 (9): 1866–1867. doi:10.1021/ja017833p