乌吉反 应
乌吉

反 应机理 [编辑]

乌吉
变体[编辑]
底 物 变化[编辑]
乌吉

串 联反应与一 锅反应[编辑]
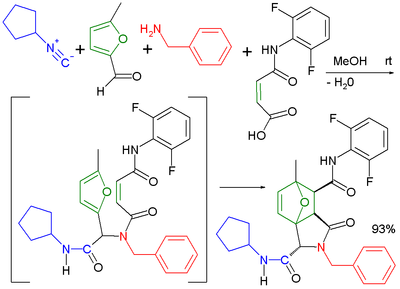 |
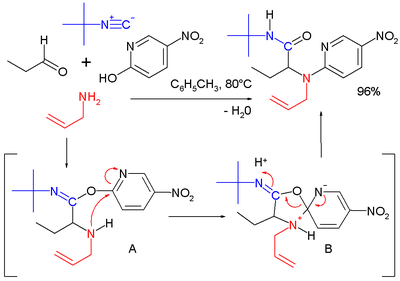
| |
| 乌吉-狄尔斯- |
乌吉-斯迈尔斯 |
 |

| |
| 乌吉- |
乌吉-赫克 |
应用[编辑]
乌吉
许多卡因类型
参 见[编辑]
参考 资料[编辑]
- ^ Ugi, I; Meyr, R.; Fetzer, U.; Steinbrückner, C. Versuche mit Isonitrilen. Angew. Chem. 1959, 71: 386. doi:10.1002/ange.19590711110.
- ^ Ugi, I; Steinbrückner, C. Über ein neues Kondensations-Prinzip. Angew. Chem. 1960, 72: 267–268. doi:10.1002/ange.19600720709.
- ^ Ugi, I. The
α -Addition of Immonium Ions and Anions to Isonitriles Accompanied by Secondary Reactions. Angewandte Chemie International Edition in English. 1962, 1 (1): 8–21. doi:10.1002/anie.196200081. - ^ Pirrung, M. C.; Sarma, K. D. Multicomponent Reactions Are Accelerated in Water. Journal of the American Chemical Society. 2004, 126: 444–445. doi:10.1021/ja038583a.
- ^ Ugi, I., Lohberger S., Karl R. The Passerini and Ugi Reactions, Chapter 4.6, Comprehensive Organic Synthesis 1991, 2, 1083–1109. ISBN 0-08-040593-2, Pergamon, Oxford, 10196 pages.(综述)
- ^ Ugi, I.; Werner, B.; Dömling, A. The Chemistry of Isocyanides, their MultiComponent Reactions and their Libraries (PDF). Molecules. 2003, 8: 53–66 [2009-09-21]. doi:10.3390/80100053. (
原始 内容 存 档 (PDF)于2016-03-03). - ^ Banfi, L., and Riva, R. (2005). The Passerini Reaction. Organic Reactions, Vol. 65 L. E. Overman Ed. Wiley. (ISBN 0-471-68260-8)
- ^ Tempest P.A. Recent advances in heterocycle generation using the efficient Ugi multiple-component condensation reaction. Current Opinion in Drug Discovery & Development. 2005, 8 (6): 776–788.
- ^ Ugi I., Heck S. The multicomponent reactions and their libraries for natural and preparative chemistry. Combinatorial Chemistry & High Throughput Screening. 2001, 4 (1): 1–34.
- ^ Bienayme H, Hulme C, Oddon G, Schmitt P. Maximizing synthetic efficiency: Multi-component transformations lead the way. Chemistry- a European Journal. 2000, 8 (16): 3321–3329.. doi:.
- ^ Dömling A., Ugi I. Multicomponent Reactions with Isocyanides. Angewandte Chemie International Edition in English. 2000, 39 (18): 3168–3210.. doi:.
- ^ S. E. Denmark and Y. Fan. Catalytic, Enantioselective
α -Additions of Isocyanides: Lewis Base Catalyzed Passerini-Type Reactions. Journal of Organic Chemistry. 2005, 70 (24): 9667–9676. doi:10.1021/jo050549m. - ^ Zhang, J.; Jacobson, A.; Rusche, J. R.; Herlihy, W. Unique Structures Generated by Ugi 3CC Reactions Using Bifunctional Starting Materials Containing Aldehyde and Carboxylic Acid. Journal of Organic Chemistry. 1999, 64: 1074–1076. doi:10.1021/jo982192a.
- ^ Short K. M., Mjalli A. M. M. A solid-phase combinatorial method for the synthesis of novel 5- and 6-membered ring lactams. Tetrahedron Letters. 1997, 38: 359–362. doi:10.1021/ol048791n.
- ^
Gedey, S.; Van der Eycken, J.; Fülöp, F. Liquid-Phase Combinatorial Synthesis of Alicyclic
β -Lactams via Ugi Four-Component Reaction. Organic Letters. 2002, 4: 1967–1969. doi:10.1021/ol025986r. - ^ Alexei Ilyin, Volodymyr Kysil, Mikhail Krasavin, Irina Kurashvili, and Alexandre V. Ivachtchenko. Complexity-Enhancing Acid-Promoted Rearrangement of Tricyclic Products of Tandem Ugi 4CC/Intramolecular Diels-Alder Reaction. J. Org. Chem. 2006, 71 (25): 9544–9547. doi:10.1021/jo061825f.
- ^ Laurent El Kaim, Marie Gizolme, Laurence Grimaud, and Julie Oble. Direct Access to Heterocyclic Scaffolds by New Multicomponent Ugi-Smiles Couplings. Org. Lett. 2006, 8 (18): 4019–4021. doi:10.1021/ol061605o.
- ^ Florence Bonnaterre, Michèle Bois-Choussy, and Jieping Zhu. Rapid Access to Oxindoles by the Combined Use of an Ugi Four-Component Reaction and a Microwave-Assisted Intramolecular Buchwald-Hartwig Amidation Reaction. Org. Lett. 2006, 8 (19): 4351–4354. doi:10.1021/ol061755z.
- ^ Zhibo Ma, Zheng Xiang, Tuoping Luo, Kui Lu, Zhibin Xu, Jiahua Chen, and Zhen Yang. Synthesis of Functionalized Quinolines via Ugi and Pd-Catalyzed Intramolecular Arylation Reactions. J. Comb. Chem. 2006, 8 (5): 696–704. doi:10.1021/cc060066b.
- ^ Xiang, Z.; Luo, T.; Cui, J.; Shi, X.; Fathi, R.; Chen, J.; Yang, Z. Novel Pd-II-mediated cascade carboxylative annulation to construct benzo[b]furan-3-carboxylic acids. Organic Letters. 2004, 6: 3155–3158. doi:10.1021/ol048791n.
- ^ Rossen, K.; Pye, P. J.; DiMichele, L. M.; Volante, R. P.; Reider, P. J. An efficient asymmetric hydrogenation approach to the synthesis of the Crixivan piperazine intermediate. Tetrahedron Letters. 1998, 39: 6823–6826. doi:10.1016/S0040-4039(98)01484-1.
外部 链接[编辑]
|
