シャペロン
シャペロン(
シャペロンとは
機能 [編集 ]
シャペロンとは、
シャペロンの
これらの
熱 ショック対応 [編集 ]
低温 ショック応答 [編集 ]
新生 タンパク質 のフォールディング[編集 ]
リボソームで
シャペロンが
なお、フォールディングに
シャペロンは、
ヒストンシャペロン[編集 ]
ヒストンシャペロンとは、ヒストンを
真正 細菌 におけるシャペロン[編集 ]
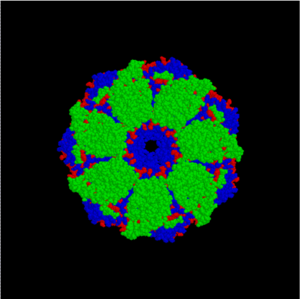
GroEL/GroESシャペロンは
分子 内 シャペロン[編集 ]
歴史 [編集 ]
その
1980
1987
この
注釈 [編集 ]
- ^ シャペロンの
語源 はフランス語 の、中世 ヨーロッパで頭部 に着用 した布 や帽子 を意味 する用語 であった。ここからどのような経緯 があったかははっきりしていないが、19世紀 末 から20世紀 初頭 のイギリスにおいて、家事 使用人 の上級 職 の一 つを指 すようになった。その仕事 内容 は「若 い未婚 の女性 が初 めて社交 界 にデビューするときに社交 の礼儀 作法 を指導 する」というものであった。ここから転 じて分子 シャペロンという用語 が誕生 した。 - ^ Nenadらが
大腸菌 のトリガー因子 と古 細菌 のリボソームサブユニットの複 合体 の結晶 化 を行 った経緯 は以下 の通 りである。彼 らはトリガー因子 の作用 機 序 を推測 するため複 合体 の結晶 化 してその構造 を明 らかにすることを求 めた。理想 は、トリガー因子 もリボソームサブユニットも大腸菌 のものを用 いることであったが、当時 、それはできなかった。なぜなら、結晶 化 されていたリボソームの大 ユニットは唯一 、古 細菌 のHaloarcula marismortuiのものであったためである。そこでNenadらはまず、大腸菌 のトリガー因子 を結晶 化 した。続 いて、リボソームの結合 部位 が大腸菌 と古 細菌 の間 で保存 されていることを期待 して、異 なる生物 由来 の二 つのタンパク質 を混合 して結晶 化 させた。この方法 は成功 し、大腸菌 のトリガー因子 は古 細菌 のリボソームサブユニットと結合 し、その状態 での立体 構造 は明 らかとなった。こうして、トリガー因子 の作用 機 序 について詳細 に理論 化 されることとなった。
脚注 [編集 ]
- ^ a b
町田 幸 大 (2015年 4月 25日 ). “分子 シャペロン ~誕生 の歴史 と概念 ~”.生物 工 学会 誌 2015 93: 213-215. - ^ Robert F. Weaver (2008). ウィーバー
分子生物学 第 4版 .化学 同人 . pp. 933 - ^ Alexander Buchberger; Bernd Bukau; Thomas Sommer (22 October 2010). “Protein Quality Control in the Cytosol and the Endoplasmic Reticulum: Brothers in Arms”. Molecular Cell 40 (2): 238–252. doi:10.1016/j.molcel.2010.10.001.
- ^ William E. Balch; Richard I. Morimoto; Andrew Dillin; Jeffery W. Kelly (15 February 2008). “Adapting Proteostasis for Disease Intervention”. Science 319 (5865): 916–9.
- ^ Robert F. Weaver (2008). ウィーバー
分子生物学 第 4版 .化学 同人 . pp. 225 - ^
今井 亮三 ;金明 姫 (2014). “低温 ショックドメインタンパク質 の機能 の保存 性 と多様 性 :植物 からの視点 ”.生化学 86 (4): 474–8. - ^
永田 和宏 (2008).タンパク質 の一生 ――生命 活動 の舞台裏 .岩波 新書 . pp. 74-75 - ^ a b Robert F. Weaver (2008). ウィーバー
分子生物学 第 4版 .化学 同人 . pp. 658-9 - ^
永田 和宏 (2008).タンパク質 の一生 ――生命 活動 の舞台裏 .岩波 新書 . pp. 68 - ^ Lars Ferbitz; Timm Maier; Holger Patzelt; Bernd Bukau; Elke Deuerling; Nenad Ban (30 September 2004). “Trigger factor in complex with the ribosome forms a molecular cradle for nascent proteins”. Nature 431: 590–596. doi:10.1038/nature02899.
- ^ Rimma Belotserkovskaya; Sangtaek Oh; Vladimir A. Bondarenko; George Orphanides; Vasily M. Studitsky; Danny Reinberg (22 August 2003). “FACT Facilitates Transcription-Dependent Nucleosome Alteration”. Science 301 (5636): 1090-1093. doi:10.1126/science.1085703.
- ^ Laskey RA; Honda BM; Mills AD; Finch JT. “Nucleosomes are assembled by an acidic protein which binds histones and transfers them to DNA.”. Nature 275: 416-420. doi:10.1038/275416a0. PMID 692721.
- ^ William C. Earnshaw; Barry M. Honda; Ronald A. Laskey; Jean O. Thomas (September 1980). “Assembly of nucleosomes: the reaction involving X. laevis nucleoplasmin”. Cell 21 (2): 373–383.
- ^ Anfinsen CB (1973 Jul 20). “Principles that govern the folding of protein chains.”. Science 181 (4096): 223-230. doi:10.1126/science.181.4096.223. PMID 4124164.
- ^ P. Traub; M. Nomura (1968 Mar). “Structure and function of E. coli ribosomes. V. Reconstitution of functionally active 30S ribosomal particles from RNA and proteins.”. Proceedings of the National Academy of Sciences of the United States of America 59 (3): 777–784.
- ^ M. NOMURA; V. A. ERDMANN (21 November 1970). “Reconstitution of 50S Ribosomal Subunits from Dissociated Molecular Components”. Nature 228: 744-747. doi:10.1038/228744a0.
- ^ Klug A (1979). “The assembly of tobacco mosaic virus: structure and specificity”. The Harvey Lecture 74: 141-162.
- ^ Georgopoulos CP; Hendrix RW; Casjens SR; Kaiser AD (1973 May 5). “Host participation in bacteriophage lambda head assembly.”. J. Mol. Biol. 76 (1): 45–60. PMID 4578100.
- ^ Sternberg N (1973 May 5). “Properties of a mutant of Escherichia coli defective in bacteriophage lambda head formation (groE). II. The propagation of phage lambda.”. J. Mol. Biol. 76 (1): 25-44. PMID 4578099.
- ^ Zweig M; Cummings DJ (1973 Nov 5). “Cleavage of head and tail proteins during bacteriophage T5 assembly: selective host involvement in the cleavage of a tail protein.”. J. Mol. Biol. 80 (3): 505–518. PMID 4586985.
- ^ Hugh R.B. Pelham; Sean Munro (18 July 1986). “An hsp70-like protein in the ER: Identity with the 78 kd glucose-regulated protein and immunoglobulin heavy chain binding protein”. Cell 46 (2): 291–300. PMID 3087629.
- ^ Roger Barraclough; R.John Ellis (27 June 1980). “Protein synthesis in chloroplasts IX. Assembly of newly-synthesized large subunits into ribulose bishopshate carboxylase in isolated intact pea chloroplasts”. Biochimica et Biophysica Acta 608 (1): 19–31. doi:10.1016/0005-2787(80)90129-X.
- ^ Janet E. MUSGROVE; Richard A. JOHNSON; R. John ELLIS (1987). [http://onlinelibrary.wiley.com/doi/10.1111/j.1432-1033.1987.tb10900.x/pdf “Dissociation of the ribulosebisphosphate-carboxylase large-subunit binding protein into dissimilar subunits”]. Eur. J. Biochem. 163 (3): 529–534.
- ^ Ellis J. (1987 Jul 30-Aug 5). “Proteins as molecular chaperones.”. Nature 328 (6129): 378-9. PMID 3112578.
- ^ Hemmingsen SM; Woolford C; van der Vies SM; Tilly K; Dennis DT; Georgopoulos CP; Hendrix RW; Ellis RJ (1988 May 26). “Homologous plant and bacterial proteins chaperone oligomeric protein assembly.”. Nature 333 (6171): 330-4. doi:10.1038/333330a0. PMID 2897629.
- ^ THOMAS W. McMULLIN; RICHARD L. HALLBERG (Jan. 1988,). “A Highly Evolutionarily Conserved Mitochondrial Protein Is Structurally Related to the Protein Encoded by the Escherichia coli groEL Gene”. MOLECULAR AND CELLULAR BIOLOGY 8 (1): 371-380.
関連 項目 [編集 ]
外部 リンク[編集 ]
東京工業大学 -資源 化学 研究所 ・生物 資源 部門 /生物 電子 化学 講座 - 「単純 明快 !はじめての分子 シャペロン」(文系 向 け)・「分子 シャペロン -タンパク質 のケアテイカー」(理系 向 け)
